编辑推荐:
该研究成果已申请了一项国家发明专利,并以 “ Therapeutic potency of compound RMY-205 for pulmonary fibrosis induced by SARS-CoV-2 nucleocapsid protein ” 为题发表在 Cell Chemical Biology 杂志
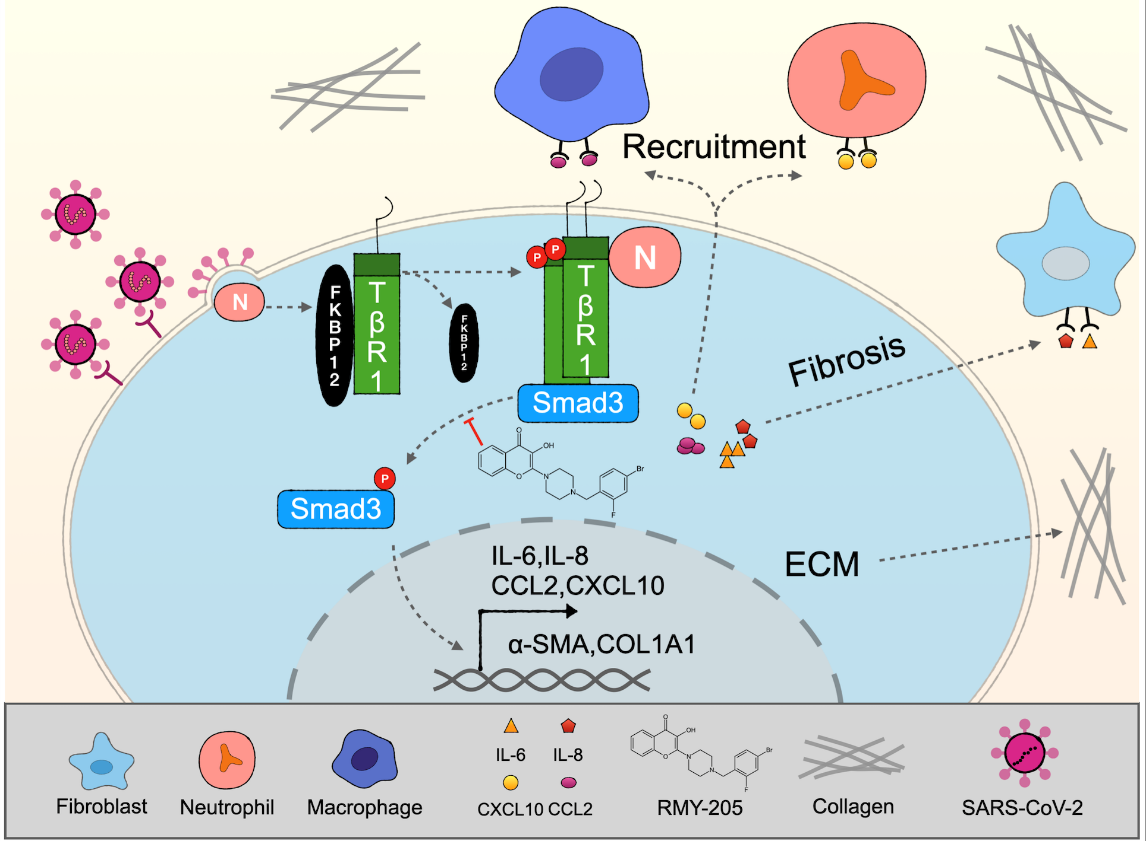
严重急性呼吸系统综合征冠状病毒2型(SARS-CoV-2)是导致新型冠状病毒肺炎(COVID-19)的主要病原体,常引起多器官功能衰竭等严重并发症,特别是肺实质病变、肺泡腔渗出、肺间质纤维化等,可导致患者肺功能不良,严重影响患者的生活质量。近日,我院李福男副教授与生命科学学院吴乔教授、林天伟教授团队合作,发现SARS-CoV-2引发肺纤维化的全新分子机制,并筛选出一种以Smad3为靶点,能有效干预肺纤维化的小分子化合物RMY-205,为治疗SARS-CoV-2引发的肺纤维化提供了新思路和新颖的先导化合物。该研究成果已申请了一项国家发明专利,并以“Therapeutic potency of compound RMY-205 for pulmonary fibrosis induced by SARS-CoV-2 nucleocapsid protein ”为题发表在Cell Chemical Biology杂志。

研究者以类黄酮化合物为先导化合物将B环结构改造为哌嗪环,以改善药物的碱性、脂水分配系数以及解离度等,设计合成了两类全新结构骨架的黄酮衍生物80多个,并通过生物学评价及构效关系等研究筛选出能够有效抑制N蛋白引起肺纤维化的小分子化合物RMY-205。研究者发现SARS-CoV-2编码的N蛋白通过激活肺成纤维细胞诱导肺纤维化:N蛋白通过抑制FKBP12与TGF-β受体(TβR1)的结合,促进TβR1自身多聚化,从而激活下游转录因子Smad3入核,调控促纤维化相关基因的表达,最终促进肺纤维化的进程。RMY-205直接靶向Smad3的MH1区域,维持Smad3 MH1和MH2区域的紧密结合,从而抑制TβR1对Smad3的磷酸化。通过搭载N蛋白的AAV在小鼠体内诱导肺纤维化,也证实了RMY-205对N蛋白诱导的小鼠肺纤维化具有良好的抑制效果。最后,研究者对RMY-205进行药代动力学分析表明,口服RMY-205的生物利用率达到了37.6%,具备良好的成药性。同时发现,RMY-205作为有效的Smad3抑制剂,也能够对Adriamycin诱导的小鼠肾纤维化有显著的抑制作用,提示RMY-205具有治疗多种器官纤维化的潜力,具有广阔的开发前景。
吴乔教授、李福男副教授和林天伟教授为该文章的共同通讯作者。生命科学学院博士生张致远、硕士生鞠翠钰、博士生吴流政、药学院硕士生颜晗以及生命科学学院博士生洪文斌为论文共同第一作者。该研究得到了国家自然科学基金项目、福建省自然科学基金项目、厦门大学新冠专项资金等多个项目的支持。
论文链接:https://www.cell.com/cell-chemical-biology/fulltext/S2451-9456(23)00053-3
 生物通微信公众号
生物通微信公众号
生物通 版权所有