编辑推荐:
近日,《Advanced Science》上发表了学院左正宏教授、何承勇副教授 团队题为“Quantum Dots-caused Retinal Degeneration in Zebrafish Regulated by Ferroptosis and Mitophagy in Retinal Pigment Epithelial Cells through Inhibiting Spliceosome”的研究论文,该研究报告了量子点(QDs)对视觉系统的影响,首次发现了纳米材料引起视网膜退行性病变及其潜在的健康风险,为颗粒物引起的视觉发育损伤的作用机制提供了新见解
近日,《Advanced Science》上发表了学院左正宏教授、何承勇副教授团队题为“Quantum Dots-caused Retinal Degeneration in Zebrafish Regulated by Ferroptosis and Mitophagy in Retinal Pigment Epithelial Cells through Inhibiting Spliceosome”的研究论文,该研究报告了量子点(QDs)对视觉系统的影响,首次发现了纳米材料引起视网膜退行性病变及其潜在的健康风险,为颗粒物引起的视觉发育损伤的作用机制提供了新见解。

视网膜退行性病变是影响全球数百万人的主要失明原因,其特征是视网膜的逐步损伤和细胞死亡。视网膜退行性病变通常由突变蛋白、缺氧、血管阻塞和光敏感性引起。新近证据表明,环境污染物,如空气颗粒物和工程纳米颗粒,也可能导致视网膜退化损伤。
量子点是一种半导体纳米材料,通常直径范围在2到20纳米。这些独特的纳米晶体具备出色的光电和发光特性,使其在发光二极管、激光器、光探测器、光伏、显示、生物成像和生物医学等应用中极具潜力。根据Global Info Research的报告,2021年全球量子点产品的收入约为45.562亿美元,预计到2028年将增长至255.7亿美元。随着广泛应用,量子点将普遍存在于制造车间、消费品、医疗设备,尤其是眼科药物中。然而,目前关于包括量子点在内的颗粒物对视网膜的影响常常被忽视。
在本研究中,作者利用斑马鱼(Danio rerio)模型研究了量子点对眼睛发育的影响及其机制。斑马鱼是一个优秀的眼科脊椎动物模型。受精后72小时(hpf),斑马鱼的视网膜已经完全发育,展现出与人类视网膜相似的形态和功能;而眼睛的完整结构及光学反应在168 hpf形成。首先筛选了多种量子点,发现金属类量子点会引起斑马鱼视网膜退行性损伤的发生,其中InP/ZnS量子点的毒性效应最为显著。因此,作者将InP/ZnS量子点作为代表进行重点研究。
作者利用荧光成像、拉曼光谱以及质谱成像等技术,证明量子点吸附富集到斑马鱼眼睛部位。随后,剥离视网膜采用Bulk RNA转录组测序和单细胞RNA测序(scRNA-seq)以及标记视网膜不同结构的转基因斑马鱼进行共聚焦成像、光片成像等,进一步发现量子点暴露会导致视网膜各类群细胞数量改变,尤其是感中长波的视锥感光细胞(PR-RGB)数量增多,而感短波的视锥感光细胞(PR-UV)数量减少。
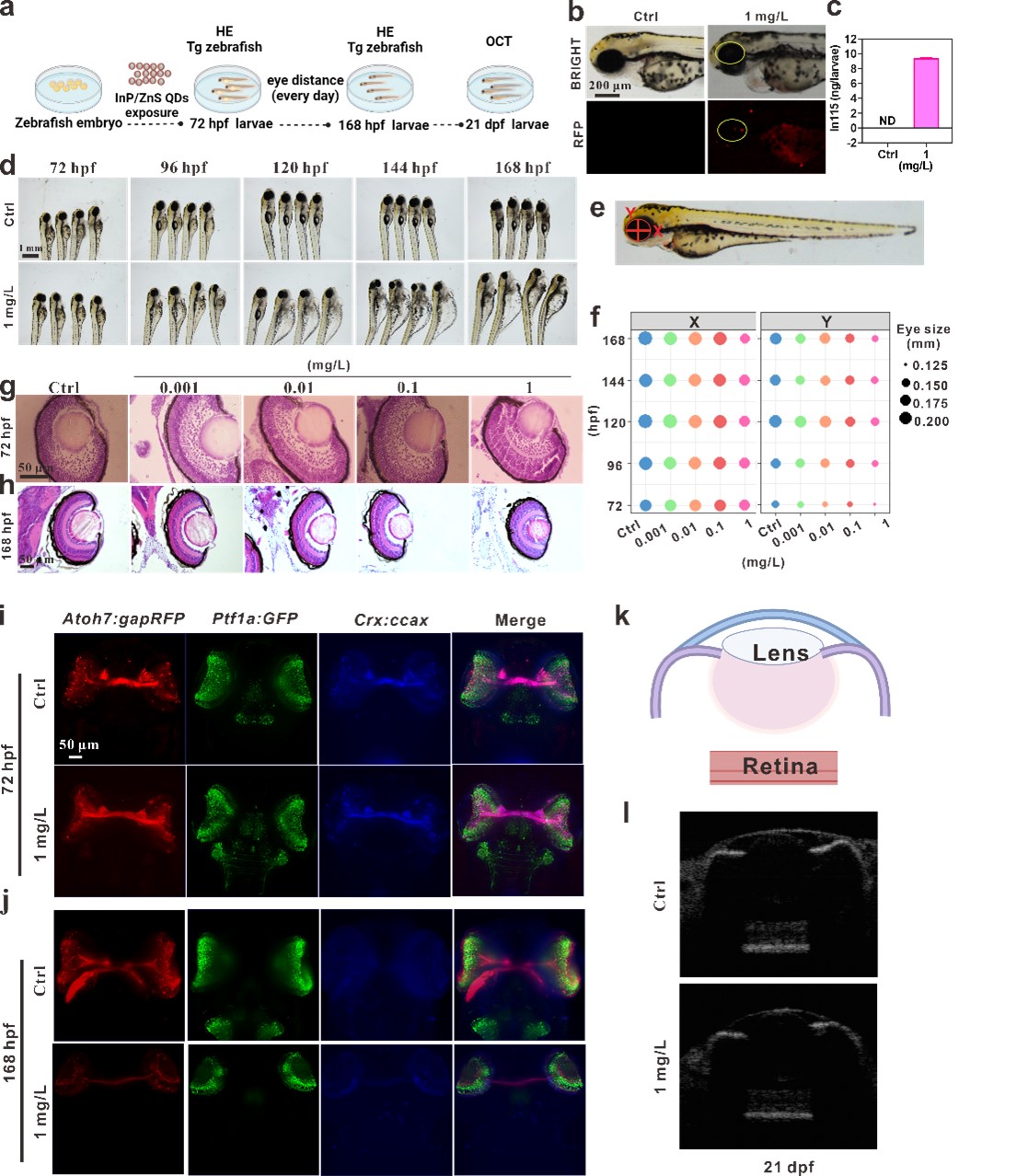
由于视网膜色素上皮细胞(RPE)的主要功能是负责吞噬受损的感光细胞膜盘,所以作者聚焦到RPE细胞。利用斑马鱼和人RPE细胞系,发现量子点引起RPE细胞铁死亡和线粒体自噬的发生。而且,利用Fer-1抑制铁死亡或者BFA1抑制线粒体自噬均能部分挽救量子点引起的斑马鱼视网膜退行性损伤。
进一步,作者聚焦到RPE细胞显著改变的更上游的剪接体通路,通过CRISPR/Cas9技术敲除prpf8剪接体因子后,发现其也会引起类似量子点暴露造成的斑马鱼视网膜退行性损伤的表型。反之,显微注射高表达prpf8能挽救由量子点引起的斑马鱼视网膜退行性损伤的发生。
那prpf8剪接体因子是如何介导RPE细胞铁死亡和线粒体自噬的呢?作者继续探索发现,量子点暴露导致prpf8表达降低后,介导了gpx4b mRNA的剪接和成熟减少,GSH含量随着下降。敲除gpx4b也会引起视网膜退行性损伤,过表达则可以挽救量子点引起的视网膜发育损伤;而直接补充GSH,也完全挽救。
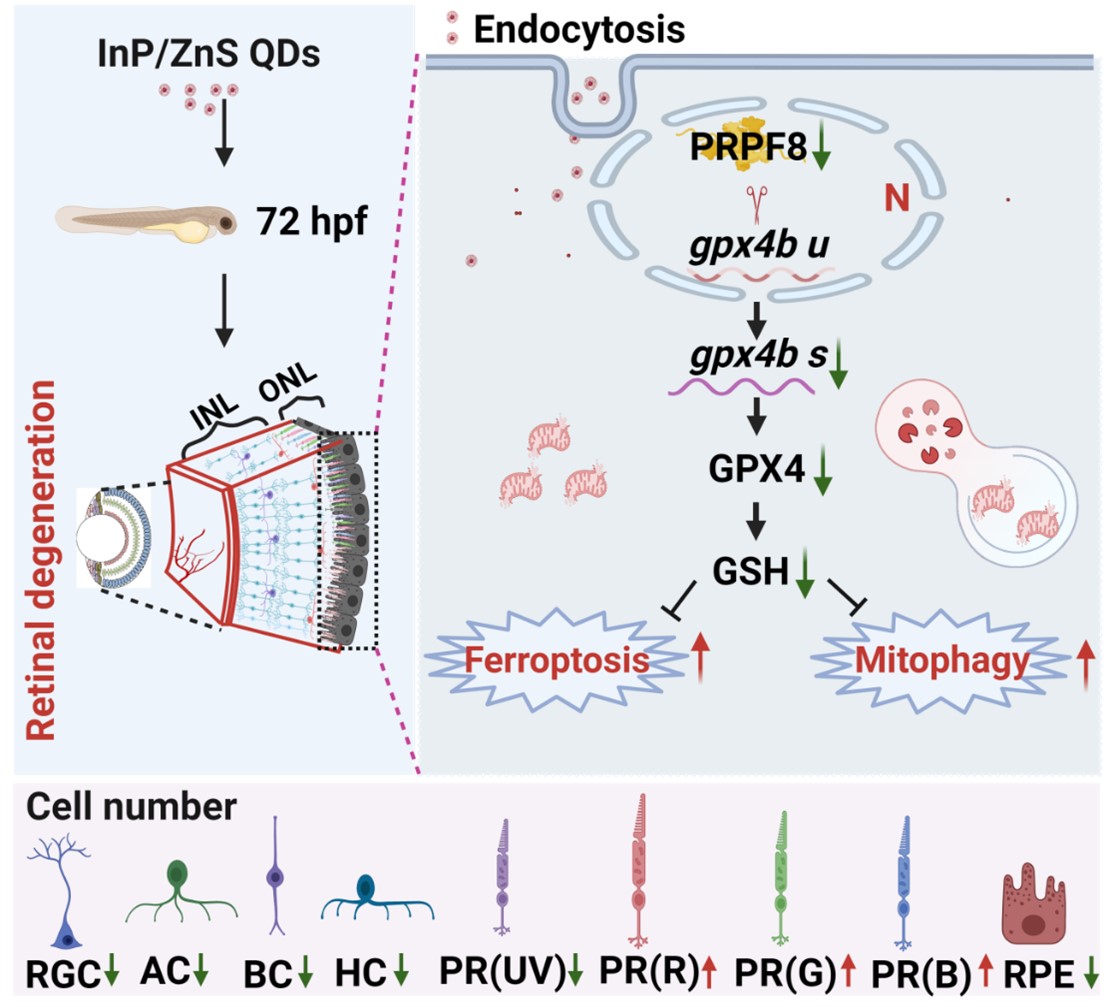
综上所述,以上研究阐明量子点被视网膜外RPE细胞内吞后,通过抑制prpf8剪接因子,从而降低gpx4b剪接和成熟,引起RPE铁死亡和线粒体自噬,进一步导致斑马鱼视网膜退行性损伤。本研究为颗粒物对视觉发育的影响及其机制提供了新认知,也为未来纳米颗粒的安全使用提供了科学指导。
厦门大学生命科学学院/附属翔安医院何承勇副教授、左正宏教授为该文章的通讯作者,课题组成员郑娜英(2021级博士研究生)为该文章唯一第一作者。厦门大学公共卫生学院赵庆亮副教授、医学院邓文波教授、化学与化工学院王翔教授、生命科学学院黄佳良教授和瞿清明教授以及广东工业大学陈智锋教授及其团队研究生也为该研究作出重要贡献。该研究受到国家自然科学基金面上项目(22376174,42177411),中央高校基础研究基金(20720232004)以及厦门大学波生生物奖学金的资助。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202406343
文/图 左正宏教授、何承勇副教授课题组
 生物通微信公众号
生物通微信公众号
生物通 版权所有