编辑推荐:
研究团队开发了一个全新的基于数据驱动的秀丽线虫模型,模拟秀丽线虫的脑、身体和环境的相互作用,使用目前最精细的线虫神经系统模型驱动线虫身体在液态环境中像真实线虫一样前行。这项研究不仅在神经科学领域具有重要意义,也为计算机科学和其他跨学科领域提供了新的研究工具和方法。
生物体的行为是大脑、身体和环境之间动态相互作用的结果。为了深入理解神经控制机制,开发数据驱动的整合生命模型模拟生命体的神经系统与行为互作用至关重要。该模型应以实验数据为基础,整合大脑、身体和环境的各种数据,准确再现生物系统的复杂动态特征,验证生命机理假设并为实验提供预测依据。目前,已有一些模型尝试模拟动物脑(如小鼠初级视觉皮层[1]、小鼠纹状体[2]和大鼠体感皮层[3])或身体与环境以再现行为(如果蝇[4]、啮齿动物[5]模型)。
2024年12月16日,北京大学未来技术学院国家生物医学成像科学中心马雷副研究员课题组在《自然·计算科学》( Nature Computational Science)期刊在线发表题为 “An integrative data-driven model simulating C. elegans brain, body and environment interactions” 的研究论文,开发了一个全新的基于数据驱动的秀丽线虫(C. elegans)模型(BAAIWorm),模拟秀丽线虫的脑、身体和环境的相互作用,使用目前最精细的线虫神经系统模型(带有离子通道和树突结构)驱动线虫身体在液态环境中像真实线虫一样前行。这项研究不仅在神经科学领域具有重要意义,也为计算机科学和其他跨学科领域提供了新的研究工具和方法。

论文截图
研究团队基于线虫神经元的真实生理特性,构建了一个生物物理层面上的高精度神经网络模型。神经网络模型中的每个神经元都被表示为一个多舱室模型,模拟神经元的结构和功能部分(如胞体、神经突),以精确复现秀丽隐杆线虫神经元的电生理特性以及基于实验数据的精细突触和间隙连接结构。基于秀丽隐杆线虫的解剖学,身体模型由96个肌肉细胞组成,在四个象限中建模,以实现计算对称性。团队在线虫身体模型表面模拟了推力和阻力,优化了计算效率,同时反映了生物体在流体环境中的互动特性。
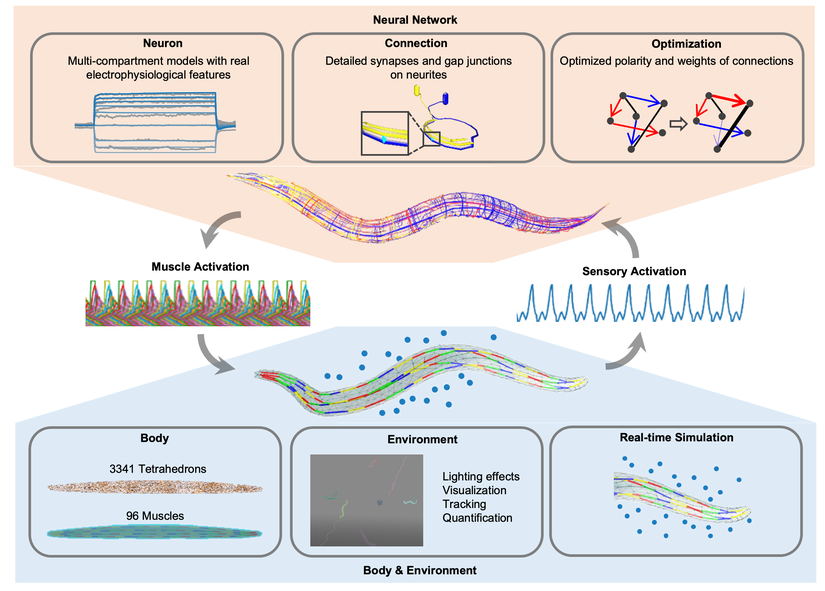
图1. 线虫模型概览。该模型包含两个子模型:神经网络模型与身体环境模型
该工作首次建立了线虫神经网络模型与身体环境模型的闭环交互,模拟线虫通过之字形运动接近食物的行为。环境中的食物浓度刺激感觉神经元,运动神经元驱动肌肉收缩,生成协调的运动轨迹。在这一过程中,研究人员可以通过模拟的方法,实时观察线虫的轨迹、神经活动以及肌肉信号(图2)。

图2. 神经网络与身体环境闭环系统的行为轨迹与信号示意图
研究者对线虫神经网络模型进行了结构性扰动实验,包括移除神经突(Neurite)、打乱突触连接权重和位置等,以探讨神经网络结构对神经活动和行为模式的影响。结果表明,神经网络的结构特性显著影响其活动模式与行为输出(图2)。这一发现为揭示神经网络如何驱动行为提供了新的视角。通过闭环的计算模型,研究人员可以更加深入地了解精细的神经网络结构的作用。
该工作提出的整合线虫模型为探讨神经控制机制提供了一个重要平台,其高生物相似性和实时模拟能力为进一步研究神经网络结构如何驱动行为铺平了道路,也为构建其他数字生命体积累了经验。未来,该模型有望通过整合更复杂的感知输入与行为数据,拓展至更多生物实验场景。该工作作为国家生物医学成像科学中心“数字生命”计划的早期成果之一,将推动生命计算与智能系统的交叉研究。
《自然·计算科学》期刊同期发表了研究简报“A simulated C. elegans with biophysically detailed neurons and muscle dynamics”,报道这一成果。期刊资深编辑Ananya Rastogi和伦敦大学学院Padraig Gleeson(本文审稿人之一、OpenWorm团队)对本工作作出了公开评价。

图3. 期刊同期发表的研究简报中对本工作的公开评价(来自期刊网页)
马雷为本文通讯作者。北京智源人工智能研究院赵梦迪博士、王宁博士为本文共同第一作者。该研究成果得到北京智源人工智能研究院的资助。
参考文献:
1. Billeh, Y. N. et al. Systematic integration of structural and functional data into multi-scale models of mouse primary visual cortex. Neuron 106, 388—403. e318(2020).
2. Hjorth, J. J. et al. The microcircuits of striatum in silico. Proc. Natl Acad. Sci. USA 117, 9554—9565 (2020).
3. Markram, H. et al. Reconstruction and simulation of neocortical microcircuitry. Cell 163, 456—492 (2015).
4. Lobato-Rios, V. et al. NeuroMechFly, a neuromechanical model of adult Drosophila melanogaster. Nat. Methods 19, 620—627(2022).
5. Merel, J. et al. Deep neuroethology of a virtual rodent. In Proc. 8th International Conference on Learning Representations 11686—11705 (ICLR, 2020).
 生物通微信公众号
生物通微信公众号
生物通 版权所有