编辑推荐:
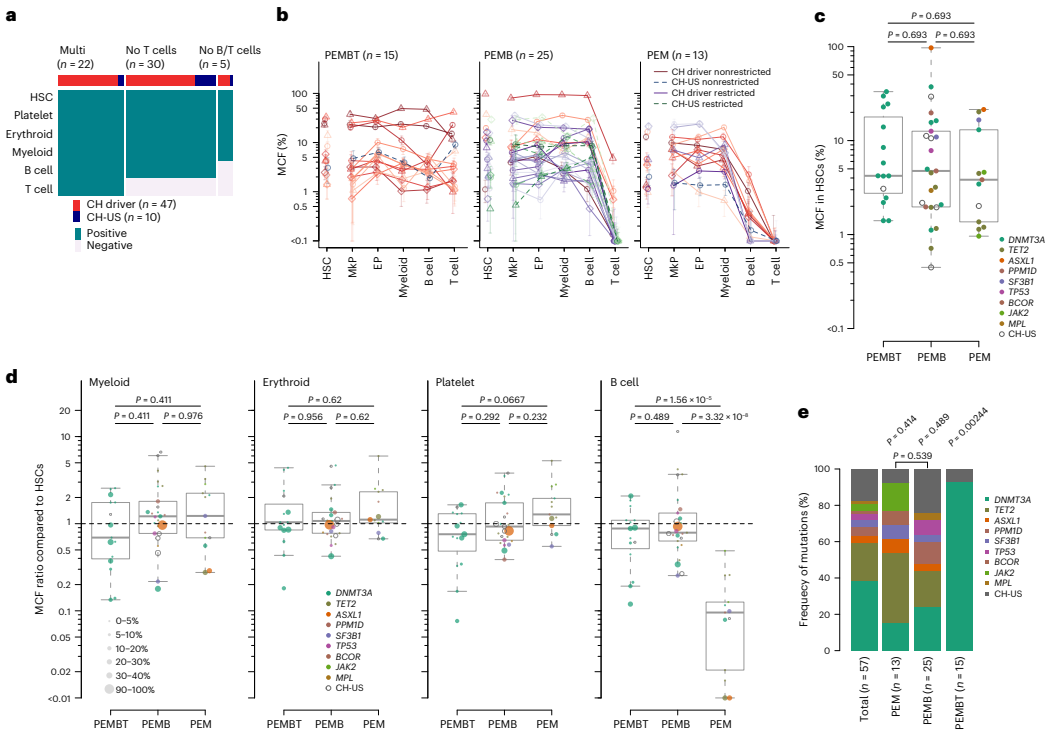
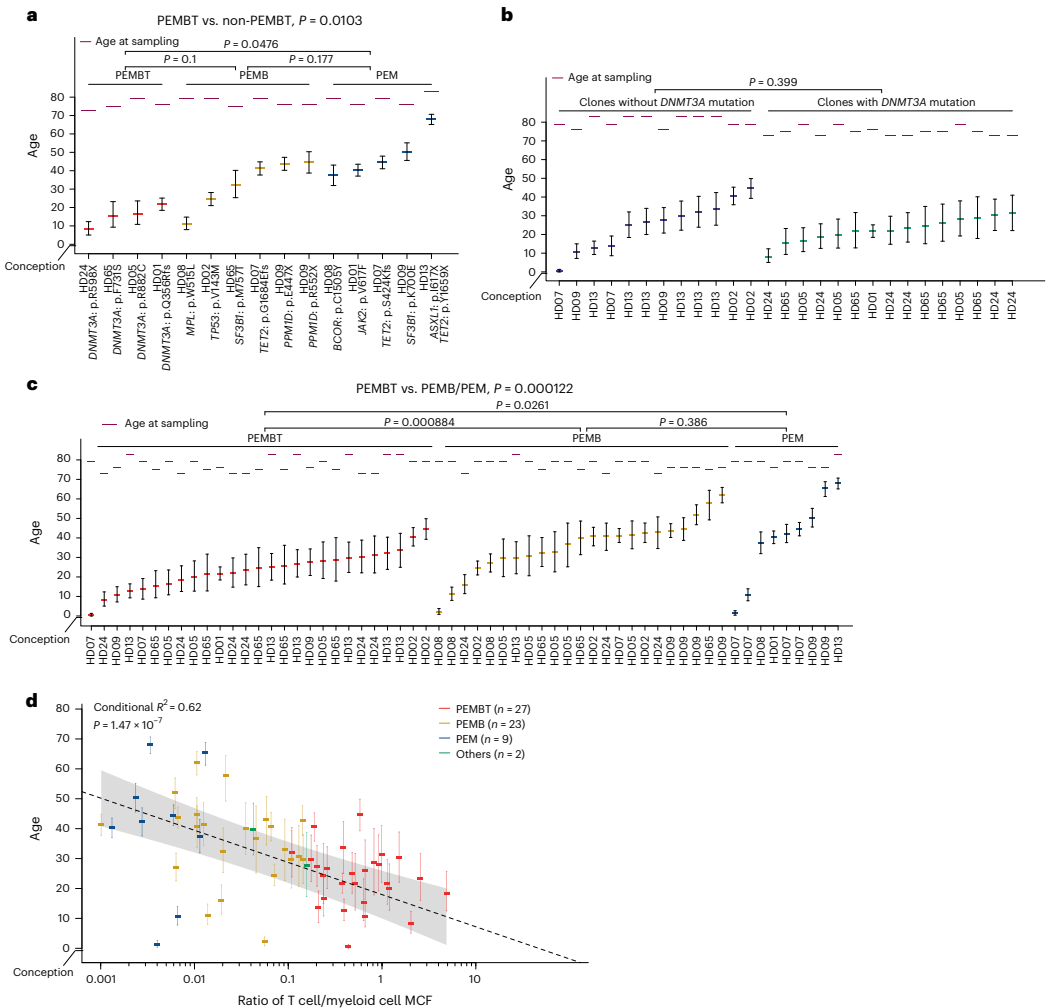
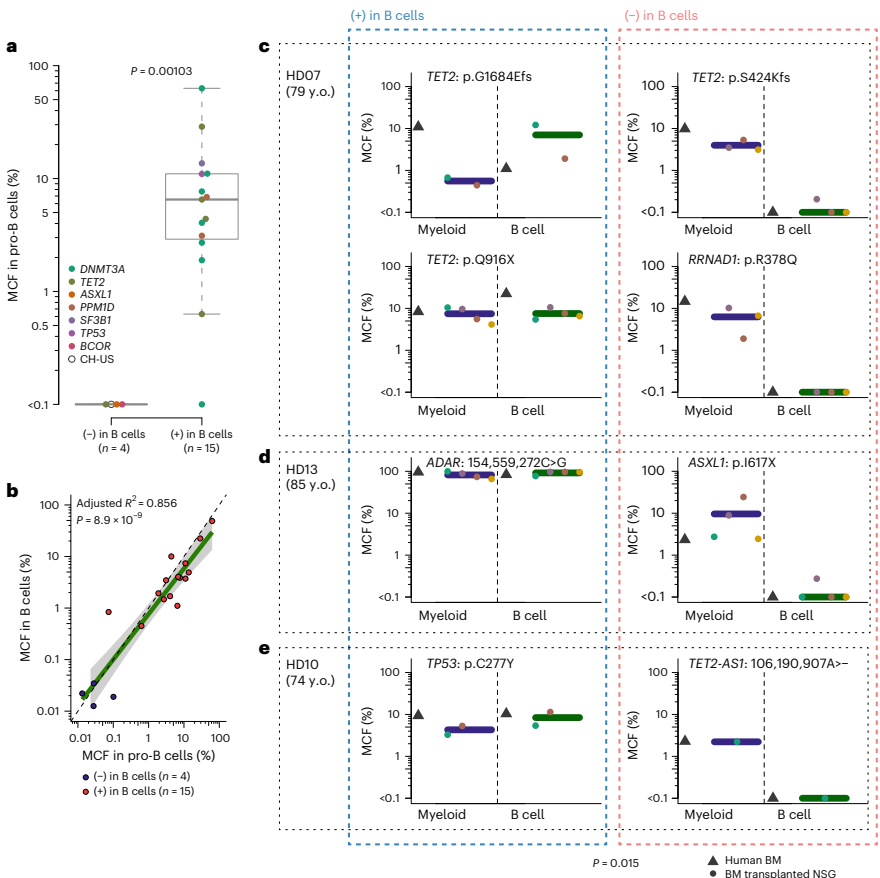
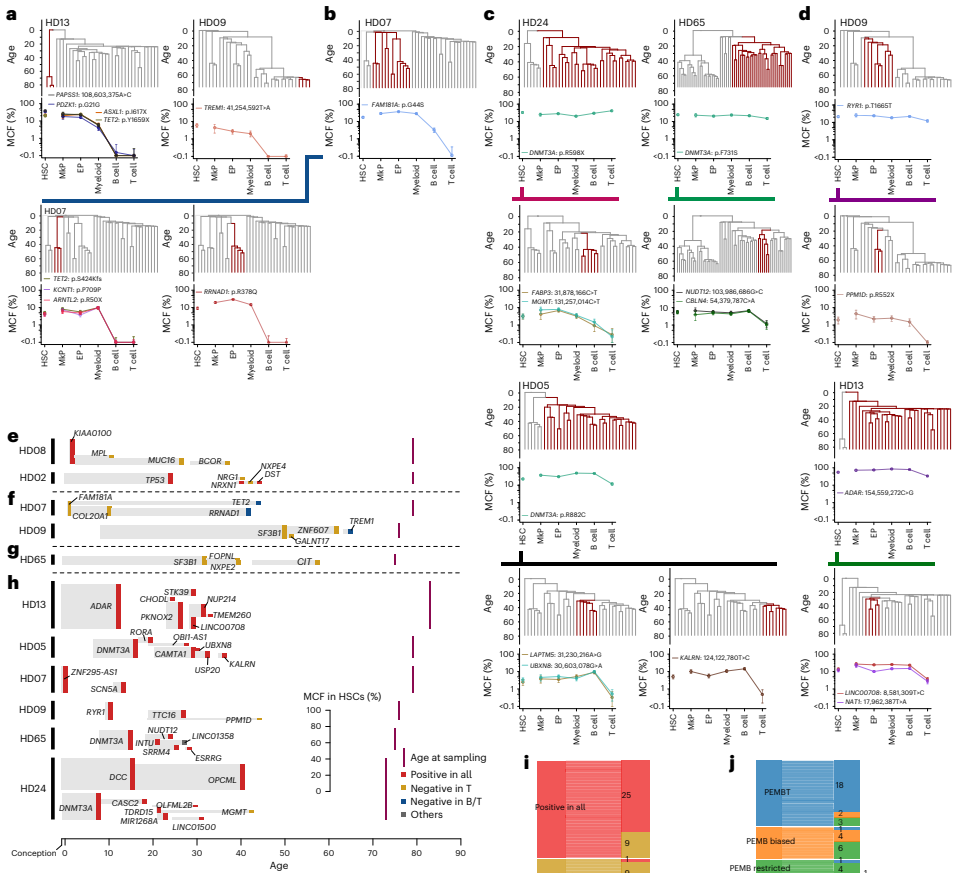
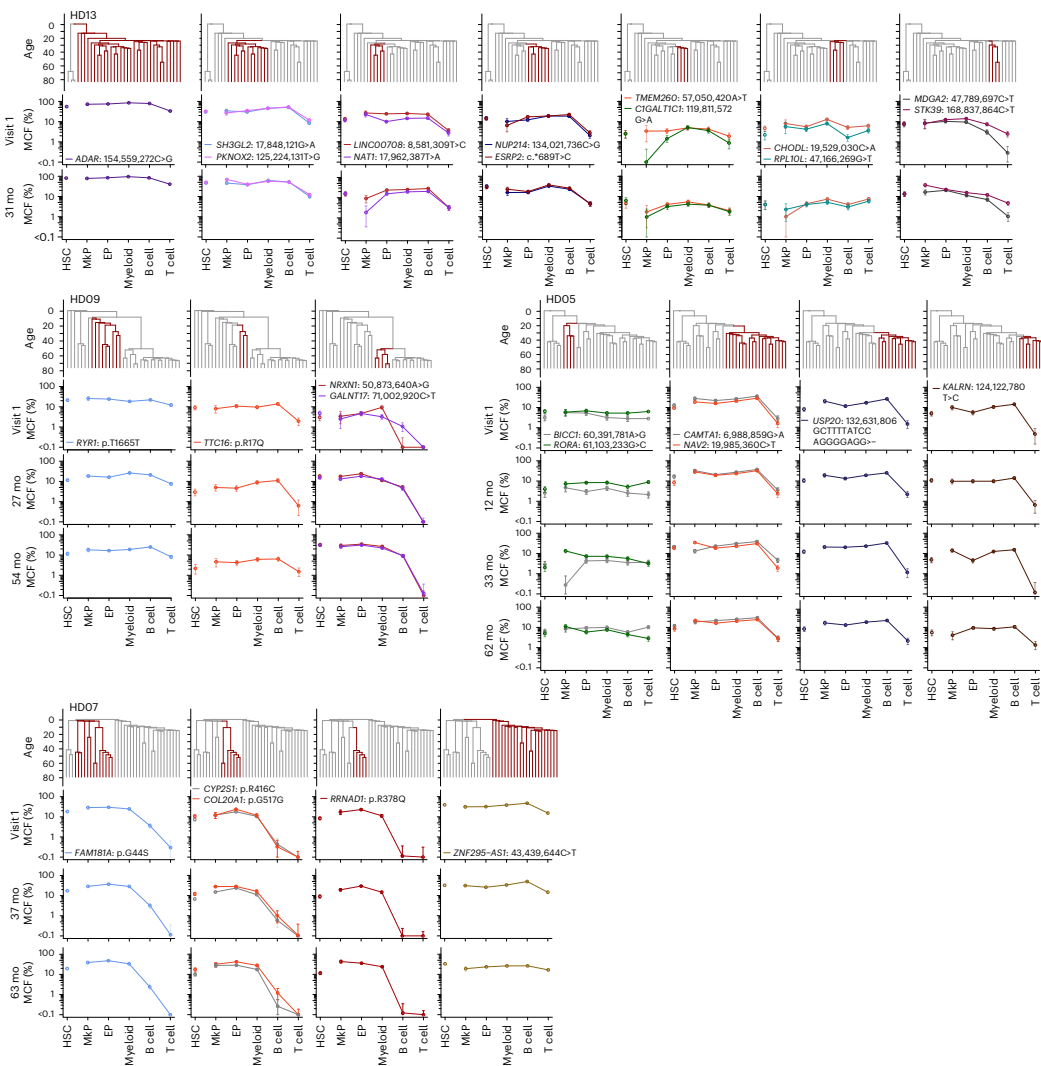
本研究通过追踪健康老年人克隆性造血(CH)突变,首次揭示了人类造血干细胞(HSC)克隆在稳态造血中具有稳定且独特的谱系贡献模式。研究人员发现除了贡献全部五系(PEMBT)的多能HSC外,还存在仅贡献髓系-红系-巨核系- B细胞(PEMB)或仅贡献髓系(PEM)的谱系限制性HSC克隆,且这些模式在数十年间保持稳定。该研究利用错误校正靶向测序(ECTS)、单细胞衍生克隆全基因组测序(WGS)和微滴数字PCR(ddPCR)等技术,证明HSC的谱系限制性是由其内在程序决定的,而非由CH驱动突变主导。这一发现对理解造血发育、衰老及相关血液疾病具有重要意义。
 生物通微信公众号
生物通微信公众号
生物通 版权所有