编辑推荐:
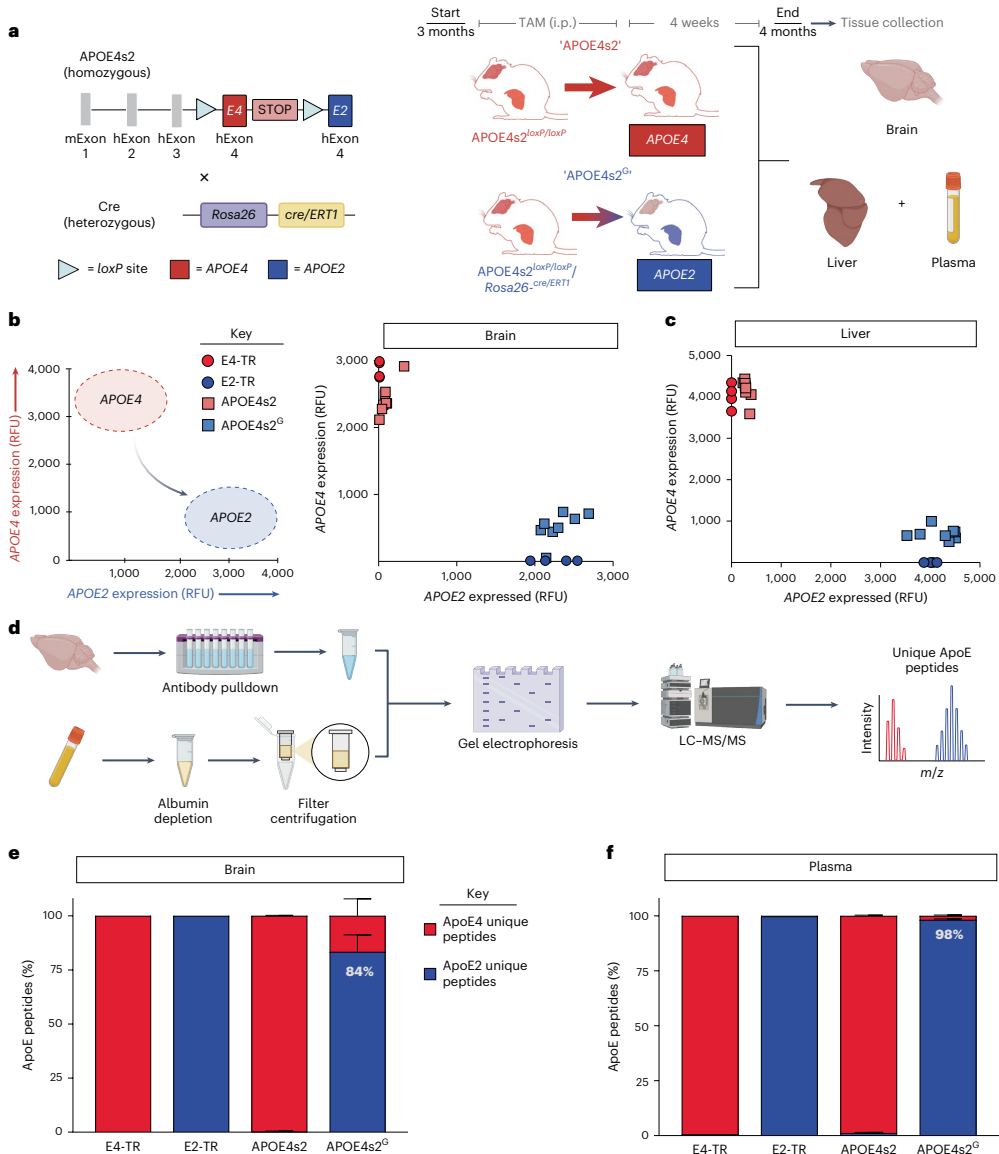
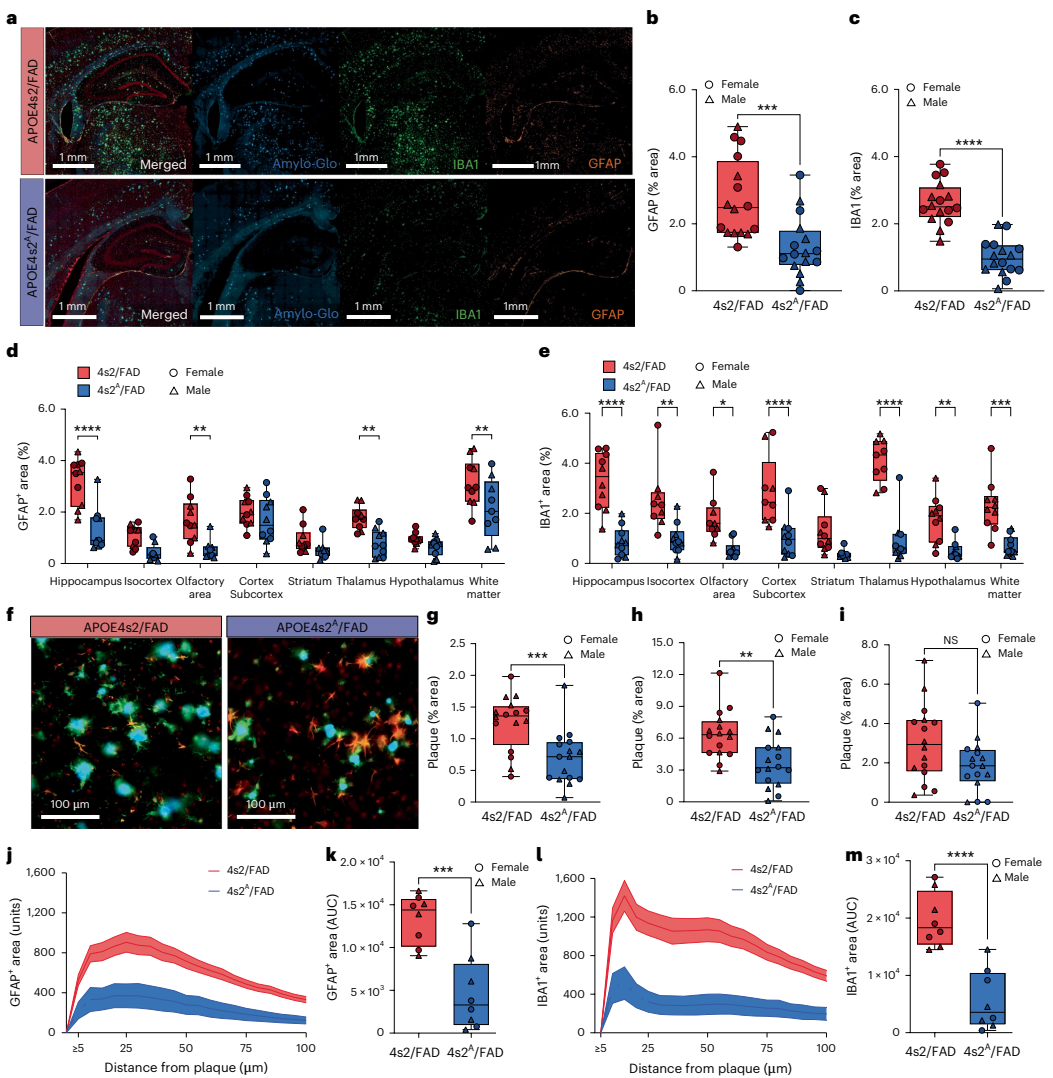
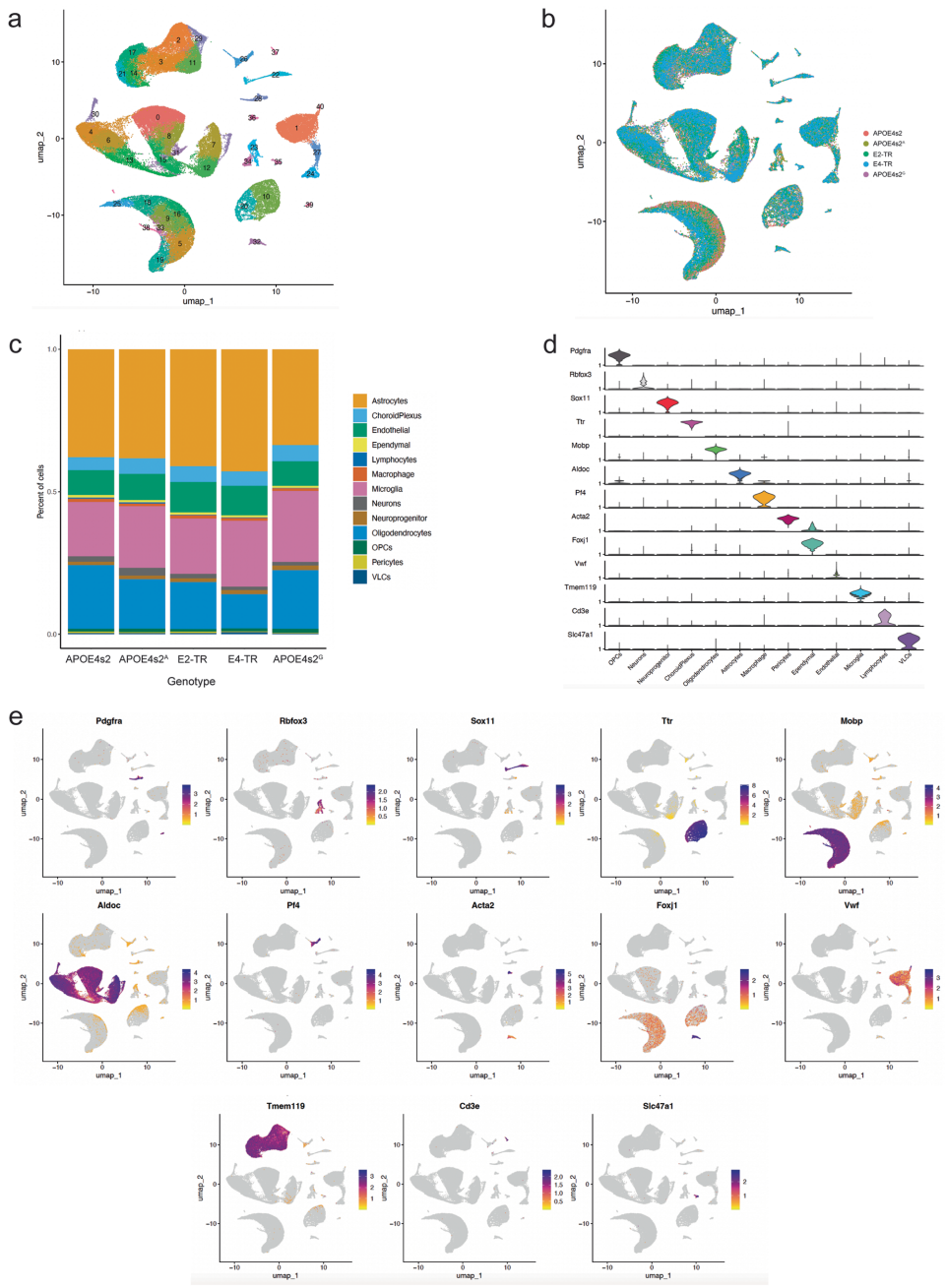
本研究针对APOE4作为晚发型阿尔茨海默病最强遗传风险因子而APOE2具有显著保护作用这一关键科学问题,开发了可诱导的APOE4向APOE2转换的小鼠模型(APOE4s2)。研究人员通过全身性和星形胶质细胞特异性等位基因转换,证实即使短期转换也能驱动AD相关的脂质组和单细胞转录组改变,特别是在星形胶质细胞中。当与5xFAD模型杂交时,星形胶质细胞特异性E4向E2转换可改善认知、减少淀粉样蛋白病理、降低胶质增生和斑块相关载脂蛋白E。这些发现为APOE基因编辑治疗策略提供了重要临床前证据。
 生物通微信公众号
生物通微信公众号
生物通 版权所有