编辑推荐:
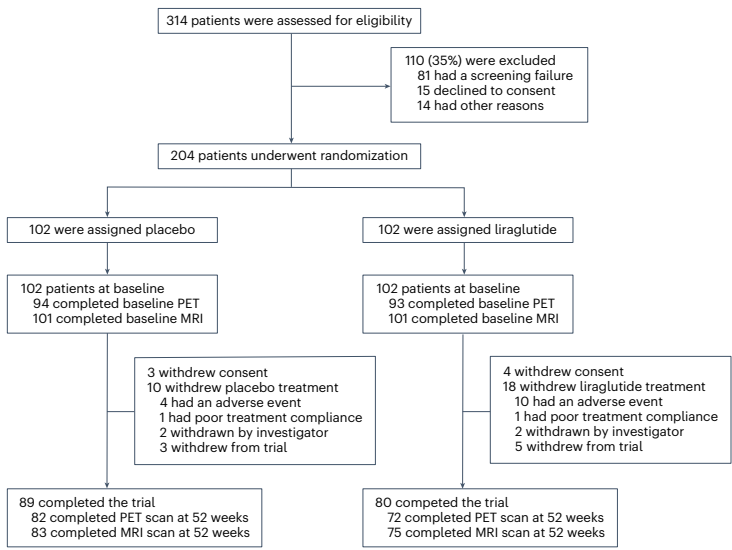
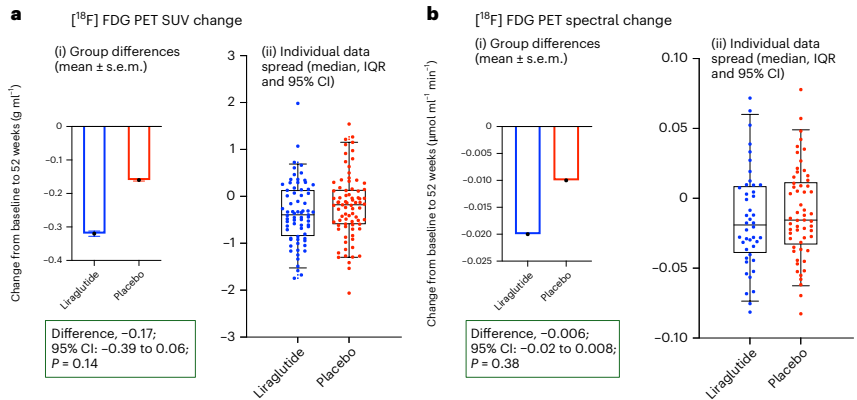
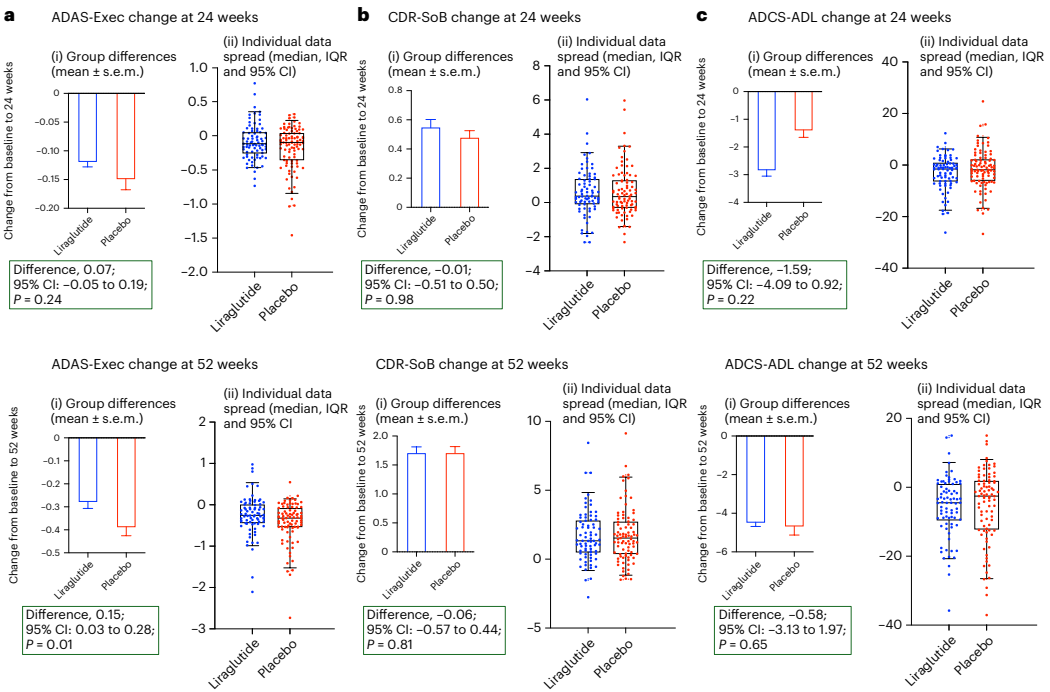
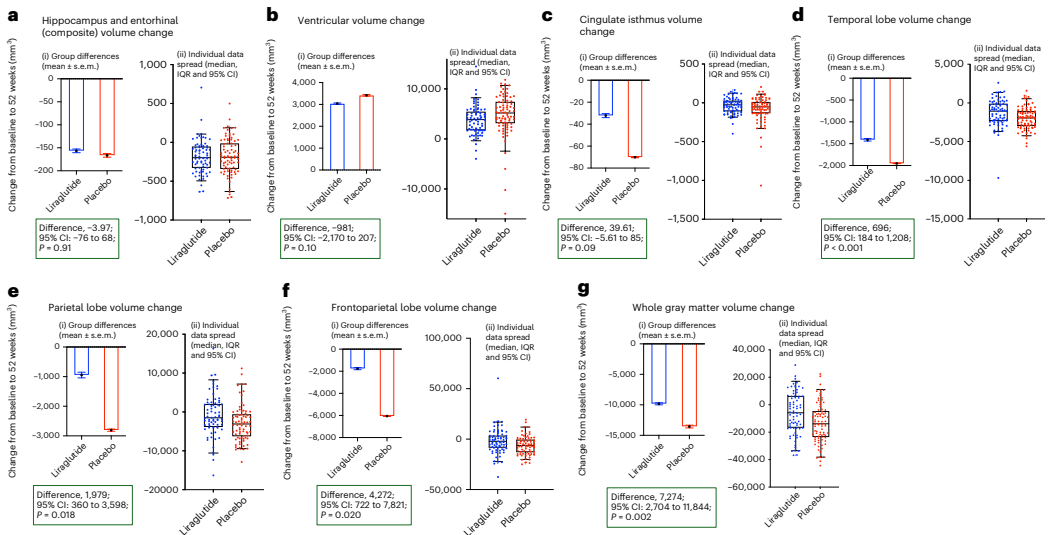
本研究针对阿尔茨海默病(AD)多病理机制的特点,开展了为期52周的多中心随机双盲安慰剂对照IIb期临床试验(ELAD),评估GLP-1受体激动剂利拉鲁肽对204例非糖尿病轻中度AD患者的安全性和有效性。结果显示虽然脑葡萄糖代谢(主要终点)无显著改善,但利拉鲁肽组在ADAS-Exec认知评分上表现出显著优势(P=0.01),且MRI显示全脑灰质体积减少减缓(P=0.002)。研究表明利拉鲁肽可能通过神经保护机制延缓AD病程进展,为GLP-1类似物在神经退行性疾病领域的应用提供了重要临床证据。
生物通 版权所有