编辑推荐:
根据发表在JCI Insight上的一项研究,西北医学院的科学家发现了数十种钾通道基因变体与新生儿癫痫之间的功能联系。
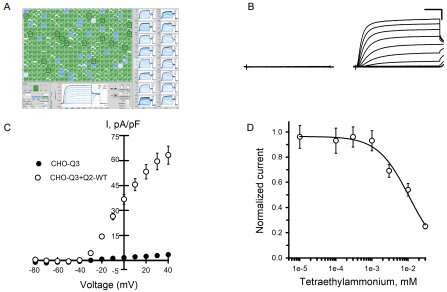
根据发表在《JCI Insight》杂志上的一项研究,西北医学院的科学家们已经发现了几十种钾通道基因变异与新生儿癫痫之间的功能联系。
该发现代表了对KCNQ2基因理解的重大进步,该研究的主要作者、主席Alfred George, Jr.医学博士和药理学教授Alfred Newton Richards说。
KCNQ2是首批与癫痫基因形式相关的基因之一。KCNQ2的致病性变异的功能丧失损害了神经元中的电压门控钾通道,在调节神经元兴奋性的电流中产生干扰。在癫痫患者中发现的数百种KCNQ2变异中,只有一小部分得到了功能评估,大多数变异被归类为“不确定意义变异”(VUS)。
在当前的研究中,George与主要作者、药理学研究副教授Carlos G. Vanoye博士一起,使用高通量膜片钳记录来测量81个KCNQ2变异对中国仓鼠卵巢细胞的影响。这些细胞天生缺乏KCNQ2,因此科学家可以引入该基因的变异,并测量通过钾离子通道的电流变化。
“在我们的研究之前,整个文献只有大约50个基因突变对其功能影响的研究;我们研究了81个,”乔治说,他也是药物基因组学中心的主任。“这有助于证明这些变异导致癫痫的分子缺陷。”
George说,在研究的81种KCNQ2变异中,近60种与癫痫有关,而其余的很少在健康人群中发现。正常情况下,每个钾离子通道需要两个编码KCNQ2蛋白的基因拷贝,许多被检测的变种是“显性阴性”,即使与正常的KCNQ2基因配对,也会损害功能,毒害整个钾离子通道。
乔治说:“这些变体中有许多导致了功能的严重丧失。”
与正常的KCNQ2相比,一小部分变异在功能上几乎没有差异,这表明他们在癫痫患者中的发现可能是偶然的,或者功能障碍可能只存在于人类神经元中。对于所有研究过的基因变体,乔治和他的合作者计划与基因检测公司分享发现,并更新ClinVar(由美国国立卫生研究院管理的基因变体公共档案)的条目。
此外,临床前试验表明,某些变异的患者可能对fda批准的药物ezogabine(又称瑞嘉滨)的治疗有反应。将药物注射到具有致病性变异的细胞中,恢复了某些细胞的钾离子通道功能,但在变异细胞中效果是高度不同的。Ezogabine/ retgabine已因低剂量和副作用而退出市场,但George表示,他相信Ezogabine/ retgabine对某些KCNQ2变异的患者可能是一种有用的工具。
“有致病性变异的婴儿和幼儿可能会受益,”乔治说。“我们希望与制药公司合作,确定我们在实验室中发现的瑞格宾变体的反应是否与在患者身上观察到的临床反应相一致——这可能有助于推动癫痫精确治疗的进展。”
 生物通微信公众号
生物通微信公众号
生物通 版权所有