编辑推荐:
亥姆霍兹慕尼黑大学的研究人员与日本东北大学的同事合作,发现了一种特殊的氧化还原蛋白PRDX6铁死亡的关键调节因子,铁死亡是一种受调节的氧化细胞死亡形式。
铁死亡是一种受调控的细胞死亡方式,其特征是无限制的铁依赖性(磷)脂质过氧化,已成为氧化还原细胞生物学的一个重要方面,也是治疗人类疾病的一个有希望的靶点。值得注意的是,由于其在治疗(化疗)耐药和转移性癌症的潜力,使癌细胞对铁死亡敏感是一种很有希望的抗癌方法;另一方面,预防神经元铁死亡可能有助于减缓神经退行性疾病——如阿尔茨海默氏症和多发性硬化症(MS)——的进展,使铁死亡成为未来治疗方法的一个非常有希望的靶点。因此,寻找可行的治疗靶点来诱导铁死亡,研究最终决定铁死亡敏感性的细胞机制,是研究重点。
细胞有各种防御系统来解毒有害的磷脂氢过氧化物(PLOOH),以避免铁死亡。硒依赖性谷胱甘肽过氧化物酶4 (GPX4)是铁死亡的守护者, 通过以谷胱甘肽(GSH)为代价,直接将磷脂氢过氧化物(PLOOH)还原为相应的醇类以减少PLOOH,防止无限制的(磷)脂质过氧化,在预防铁死亡中起着至关重要的作用。
亥姆霍兹慕尼黑大学与日本东北大学的研究人员观察到缺乏GPX4的细胞仍然表现出大量的PLOOH还原能力,表明细胞中存在替代途径。通过仔细研究潜在的候选者,他们发现:PRDX6(过氧化物还氧蛋白6(),一种巯基特异性抗氧化酶,呈过表达,PRDX6具PLOOH还原活性,不能防止铁死亡,但其遗传缺失会使癌细胞对铁死亡敏感。过氧化物还蛋白6 (PRDX6)是铁凋亡的关键调节因子。
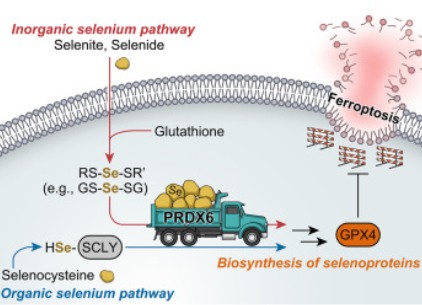
在机制上,他们发现PRDX6除了已知的过氧化物酶活性外,还可以作为硒载体蛋白,促进细胞内硒的利用,并有效地将硒结合到硒蛋白中(包括GPX4),在细胞防御氧化应激中发挥重要作用。GPX4在PRDX6缺陷小鼠脑中的表达减少,以及PRDX6缺陷小鼠肿瘤异种移植物对铁死亡的敏感性增加,强调了PRDX6在指导细胞硒利用和决定铁死亡敏感性方面的关键作用。研究结果表明,PRDX6可能成为治疗癌症和神经退行性疾病的重要靶点。这项研究发表在2024年11月14日的《Molecular Cell》杂志上。
研究亮点
• PRDX6是铁死亡监测的关键调节因子
• PRDX6作为硒受体,促进硒的利用
• 硒通过GS-Se-SG与PRDX6 C47共价结合,作为首选底物
• PRDX6缺乏降低脑GPX4,增加肿瘤对铁死亡的易感性
硒是一种对人体健康至关重要的微量营养素,也是各种硒蛋白的组成部分。硒是以希腊月亮女神塞勒尼的名字命名的。其中,硒酶谷胱甘肽过氧化物酶4 (GPX4)尤为突出,它通过保护细胞免受破坏性(磷)脂质过氧化作用,在防止铁死亡中发挥关键作用。团队专注于PRDX6,因为它的过氧化物酶活性与GPX4相似。虽然PRDX6的过氧化物酶功能相对较弱,但缺乏PRDX6的细胞对铁死亡的敏感性显著增加,尤其是在癌细胞中。受这一意外发现的启发,研究人员发现了PRDX6在细胞硒代谢中的关键功能。除了作为过氧化物酶,PRDX6还作为硒载体蛋白,对有效的细胞内硒运输至关重要。这种硒转运作用促进了硒与硒蛋白的结合,从而调节GPX4水平并影响铁死亡的敏感性。亥姆霍兹慕尼黑和东北大学医学院代谢和细胞死亡研究所的高级科学家Eikan Mishima博士说:“PRDX6是一种硒载体蛋白,其分子特性长期以来一直是假设的,但尚未确定。”
研究人员进一步研究了PRDX6在小鼠中的重要性,发现PRDX6缺乏抑制肿瘤生长。此外,缺乏PRDX6的小鼠大脑中硒蛋白水平降低,强调了PRDX6在硒转运和神经保护中的重要性。这些发现强调了PRDX6在癌症生物学和脑健康中的重要意义。
这一发现为新的治疗方法开辟了令人兴奋的可能性。由于耐药和转移性癌症对铁死亡特别敏感,抑制癌症中的PRDX6可提高铁死亡敏感性,为癌症治疗提供新的途径。“此外,由于PRDX6在维持大脑硒蛋白水平方面的新作用,它有望用于神经退行性疾病的治疗。”作者之一的Conrad解释说。这些关于PRDX6功能的新见解将与德国维尔茨堡大学 Friedmann Angeli实验室的一项伴随研究一起发表在同一期的《Molecular Cell》上,强调这些发现对未来癌症和神经退行性疾病研究的重大科学兴趣和潜在影响。
 生物通微信公众号
生物通微信公众号
生物通 版权所有