编辑推荐:
本研究针对经颅超声刺激(TUS)在神经调控中面临的时空精准控制难题,开发了全息经颅超声(hTUS)技术。通过512通道球形阵列实现多焦点协同刺激,结合宽场钙成像证实hTUS可将激活阈值降低一个数量级(0.9 MPa vs 2.5 MPa),并首次建立双模型框架(USEM和sCNM)揭示网络互作机制。该成果为探索分布式脑网络功能提供了创新工具,发表于《Nature Biomedical Engineering》。
在神经科学和神经疾病治疗领域,精准调控大脑功能一直是研究者追求的目标。当前主流的非侵入性脑刺激技术如经颅磁刺激(TMS)和经颅直流电刺激(tDCS)存在空间分辨率低、穿透深度有限等问题。经颅超声刺激(TUS)因其毫米级空间分辨率和深部脑区穿透能力被视为革命性技术,但其发展面临两大瓶颈:难以实现精确的时空控制,以及缺乏对超声与神经组织相互作用机制的深入理解。传统单焦点TUS在探索脑网络功能时尤显不足,因为大脑功能依赖于分布式回路的协同工作。
苏黎世大学和以色列理工学院的研究团队在《Nature Biomedical Engineering》发表突破性研究,开发出全息经颅超声(hTUS)神经调控技术。通过512元素球形相控阵实现多焦点动态 steering,结合宽场荧光钙成像系统,首次证实hTUS可通过协同激活分布式神经网络将刺激阈值降低10倍。研究建立的经验-机制双模型框架揭示了辐射力驱动的网络互作机制,为理解超声神经调控提供了新范式。
关键技术包括:(1)定制512通道3MHz球形相控阵实现亚毫米级聚焦(<250μm横向);(2)GCaMP6f转基因小鼠皮层宽场钙成像(20Hz);(3)荧光热标记(FTT)校正技术消除温度伪影;(4)超声激发模型(USEM)量化辐射力与激活概率关系;(5)简化皮层网络模型(sCNM)模拟多节点协同激活机制。实验使用10只5-7周龄Thy1-GCaMP6f小鼠(4雌6雄),经伦理审查批准。
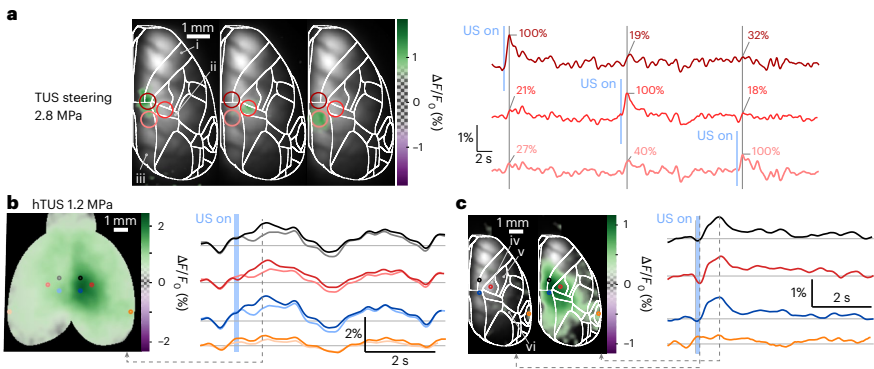
【TUS诱导局部皮层激活】
采用150ms连续超声脉冲(20-131 W/cm2 ISPPA)刺激麻醉小鼠体感皮层,通过FTT校正的钙信号显示:单焦点TUS在2.5MPa阈值以上可诱发精确空间对应的Ca2+响应(ANOVA P<0.05),而听觉皮层无显著激活(P=0.758)。

【hTUS显著降低激活阈值】
将阵列分为170元素/焦点组成三角形模式(0.5mm半径)时,激活阈值降至0.9MPa,较单焦点降低72%。声功率分析显示hTUS在0.1W即可激活2mm2区域,而单焦点需>0.1W。
【超越峰值压力的US激发模型】
USEM模型揭示总辐射力(0.15mN)比峰值压力更能预测激活概率。hTUS的激活概率密度(APD)分布显示多焦点产生协同效应,与实验数据定性吻合。

【TUS/hTUS响应的生理基础】
sCNM模型显示:单焦点刺激时,温度依赖性钾电流(IKT)会抑制后期放电;而hTUS通过AMPA受体电流(IAMPA)增强节点间同步,使三节点网络在1.1倍阈值压力下即可维持持续放电。

该研究突破了传统超声神经调控的"压力-频率"二元范式,首次证实分布式刺激可通过神经网络协同作用显著提升效能。技术层面,全息声场操控与多模态成像的结合为研究脑网络功能提供了新工具;理论层面,双模型框架为理解超声-神经相互作用提供了新视角。特别值得注意的是,hTUS在0.9MPa(相当于临床相关声强)即可有效激活神经网络,这为阿尔茨海默病等神经退行性疾病的非侵入性治疗开辟了新途径。研究者指出,未来工作将聚焦于将该技术转化至亚兆赫兹频段(适用于人类颅骨穿透),并探索其对长程脑网络连接的调控机制。
 生物通微信公众号
生物通微信公众号
生物通 版权所有