编辑推荐:
2024年12月12日,武汉大学生命科学学院赵华斌教授团队于Molecular Biology and Evolution期刊发表了题为“Dampened TLR2-mediated inflammatory signaling in bats”(蝙蝠抑制TLR2介导的炎症信号)的研究论文(图1)
2024年12月12日,武汉大学生命科学学院赵华斌教授团队于Molecular Biology and Evolution期刊发表了题为“Dampened TLR2-mediated inflammatory signaling in bats”(蝙蝠抑制TLR2介导的炎症信号)的研究论文(图1)。武汉大学生命科学学院博士研究生曾嘉鸣为论文的第一作者,赵华斌教授为论文的通讯作者。

图1. 相关论文在线发表于Mol Biol Evol
蝙蝠是多种人畜共患病毒的天然宿主,能够无症状地携带多种导致其它哺乳动物致病的烈性病毒。已有研究人员提出假说:蝙蝠与病毒共存的能力可能是由于它们可以良好的控制炎症反应,避免“细胞因子风暴”对自身的组织和器官产生破坏。为了检测该假说,武汉大学赵华斌团队研究了蝙蝠Toll样受体(Toll-like receptors, TLRs)的功能演化。TLRs是一类重要的天然免疫受体,可以识别一系列病原相关分子模式;其中TLR2常与TLR1或TLR6在细胞表面形成异源二聚体TLR2/1和TLR2/6,用以识别细胞、真菌和病毒等的脂肽成分,随后启动一系列信号传导事件,最终导致炎症因子(IL8、TNFα等)的合成和释放。
首先,研究团队对蝙蝠和其它哺乳动物TLR1、TLR2和TLR6的进化速率进行了比较,发现蝙蝠TLR2的进化速率要显著高于其它哺乳动物,并且TLR2在蝙蝠祖先位置发生了显著的加速进化,而TLR1和TLR6未出现类似的序列特征,提示TLR2经历了正选择或松弛选择。使用RELAX程序对蝙蝠TLR2的选择强度进行了计算,结果显示:蝙蝠的TLR2经历了显著的松弛选择。为了研究蝙蝠TLR2的功能是否发生了松弛,研究团队在人、黑妖狐蝠和巴西犬吻蝠的模式细胞系中,将各自物种的TLR2单独转染或与各自物种的TLR1或TLR6共转染并使用Pam3CSK4(TLR2/1激动剂)或FSL-1(TLR2/6激动剂)刺激。结果显示,人TLR2与TLR1或TLR6共转染后细胞受到对应激动剂刺激时下游炎症因子的mRNA表达量明显高于单独转染TLR2的细胞,但在两种蝙蝠细胞中却显示无明显差异。为了确定人类与蝙蝠细胞中得到不同的结果的原因,研究人员通过CoIP和交换二聚化区域的方法进行了进一步的验证,确定了蝙蝠TLR2二聚化区域的特异性改变是导致蝙蝠中异源二聚体TLR2/1和TLR2/6形成能力严重降低甚至完全消失的原因。
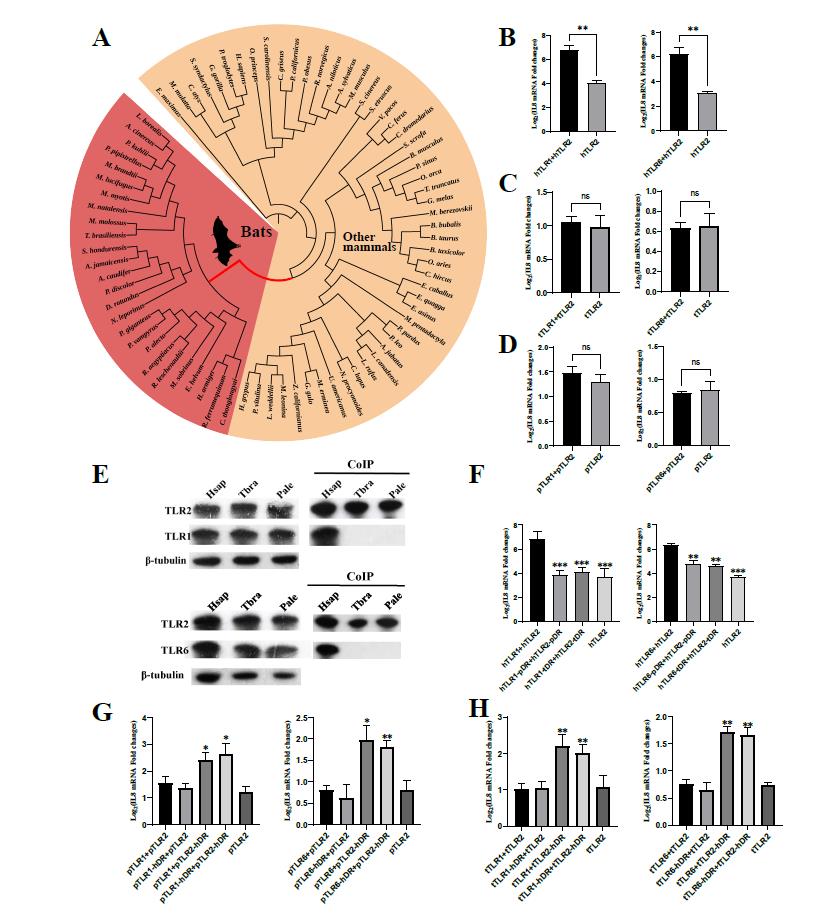
图2. 蝙蝠TLR2演化树及其二聚化能力受损的实验证据
为了解析蝙蝠TLR2二聚化能力下降的遗传学机制,研究团队对前人研究中鉴定出来的TLR2二聚化区域中直接参与和TLR1或TLR6相互作用的氨基酸位点进行了比较,发现这些位点中的相当一部分在蝙蝠中发生了特异性改变。通过丙氨酸扫描,并将黑妖狐蝠的这些氨基酸位点引入到人类TLR2中,发现TLR2第347、375和376号位点的单点突变足以对TLR2/1下游炎症因子mRNA的表达产生显著影响。通过重建蝙蝠祖先的TLR2序列,发现蝙蝠TLR2的375和376号位点在其祖先位置同时发生了突变,并通过同源建模和互作分析发现,这两个突变的同时引入将可能导致人类TLR2和TLR6之间氢键的显著减少。通过将现生蝙蝠中的375和376位点的所有组合(NF/NS/NL)引入到人类TLR2,细胞功能实验和CoIP实验均显示这两个位点的突变显著影响TLR2和TLR1以及TLR6的结合能力。
综上所述,该研究揭示了蝙蝠免疫系统抑制炎症反应的新机制,这可能是蝙蝠能够成为无症状的病毒宿主的原因之一;而且,蝙蝠特殊的免疫系统可能从蝙蝠共同祖先出现的时候就形成了。该研究还表明,蝙蝠具有作为人类抗炎研究动物模型的潜力,其免疫系统的运行机制可能为人类抗炎研究提供新的启发。
原文链接:https://doi.org/10.1093/molbev/msae253
 生物通微信公众号
生物通微信公众号
生物通 版权所有