编辑推荐:
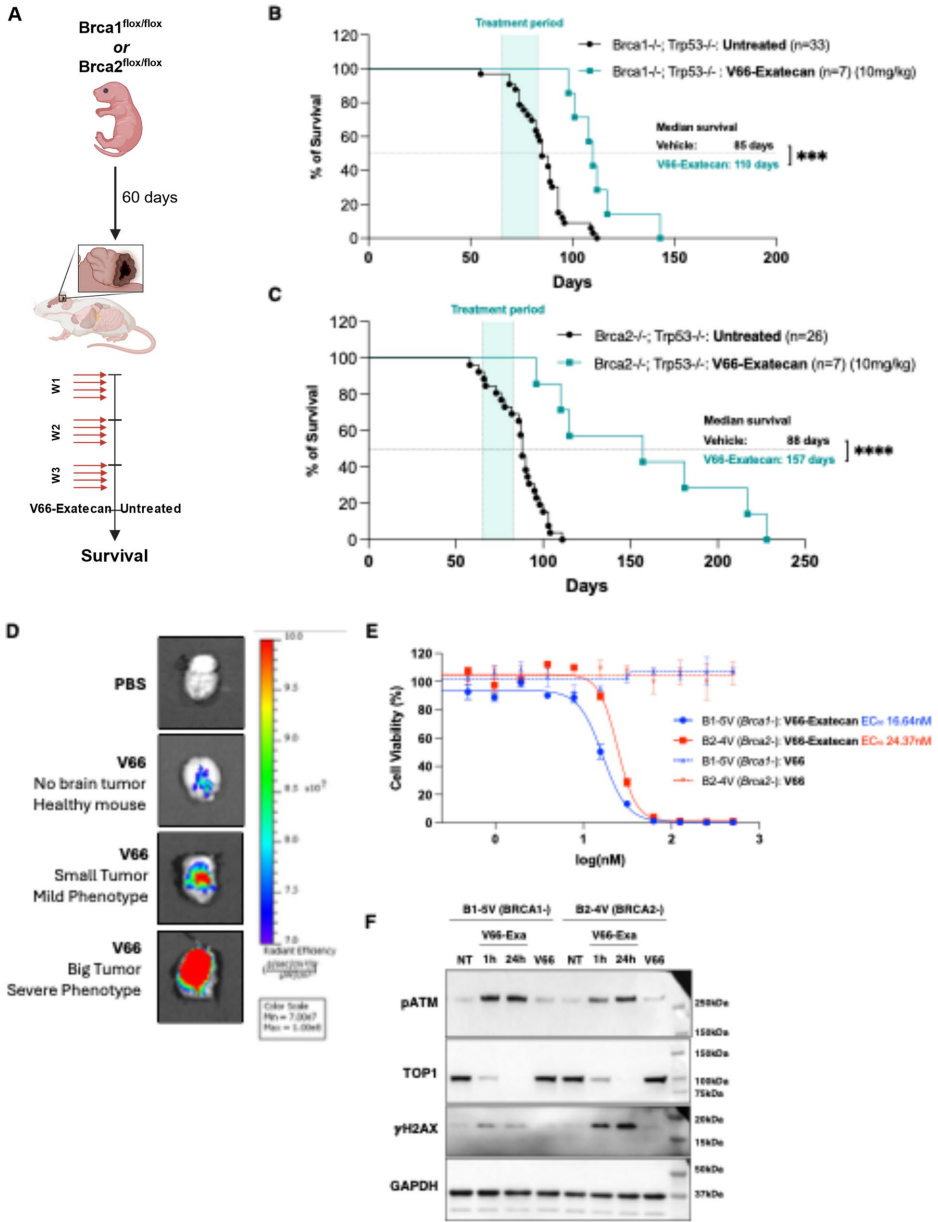
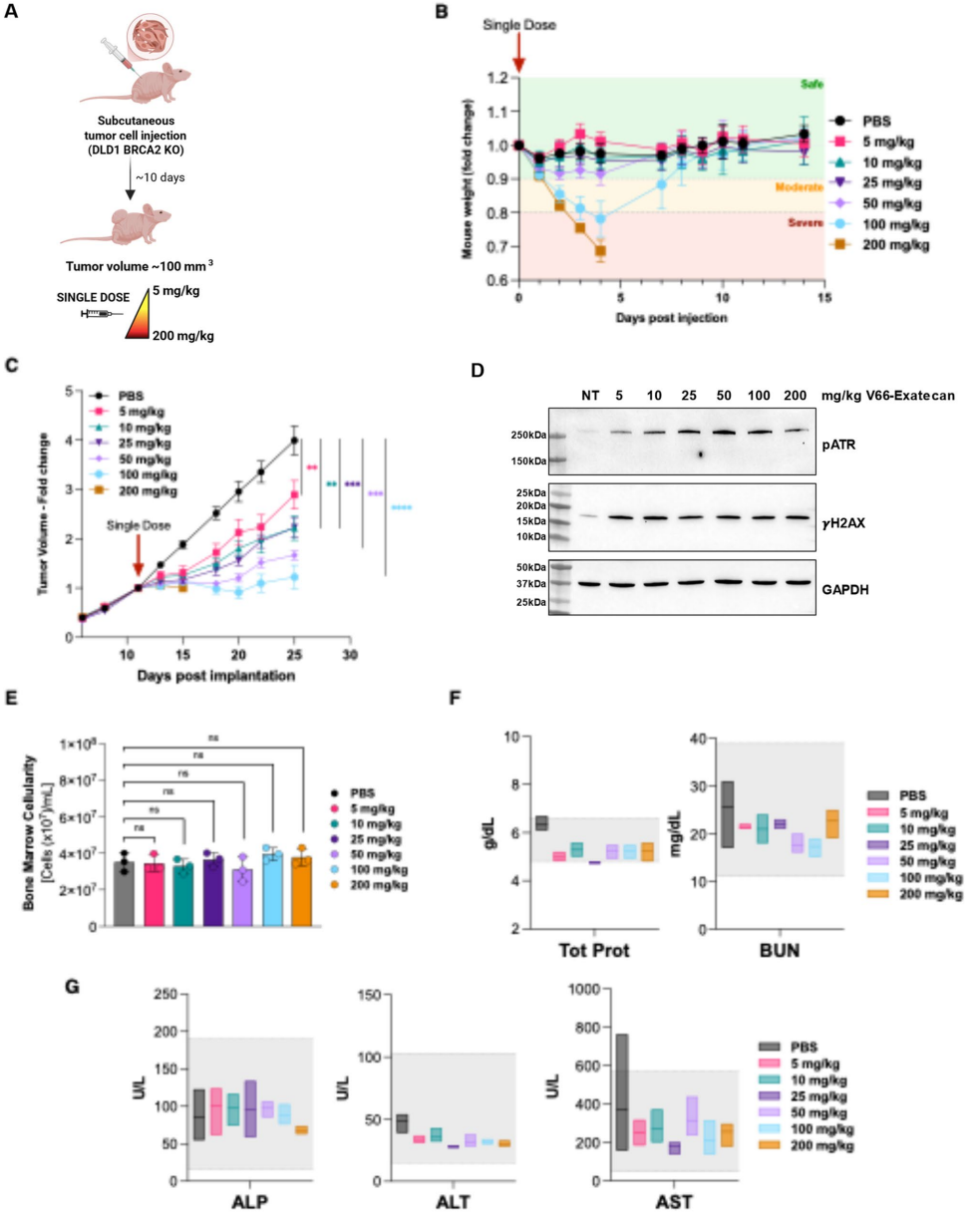
本研究针对当前抗体偶联药物(ADC)面临的肿瘤靶向性不足、内化效率低及难以抵达特殊病灶(如脑肿瘤)等局限,开发了一种基于抗胞外DNA(exDNA)抗体V66的新型ADC——V66-exatecan。该药物通过结合肿瘤微环境中的exDNA和癌细胞高表达的ENT2转运蛋白,实现核内靶向递送exatecan(TOP1抑制剂),在多种癌症模型(包括三阴性乳腺癌和BRCA缺陷型髓母细胞瘤)中诱导显著DNA损伤反应(DDR)、旁观者杀伤及肿瘤完全消退,且无显著毒性。该研究为克服传统ADC局限性提供了新策略,尤其适用于DNA修复缺陷型肿瘤和血脑屏障穿透难题的治疗。
 生物通微信公众号
生物通微信公众号
生物通 版权所有