编辑推荐:
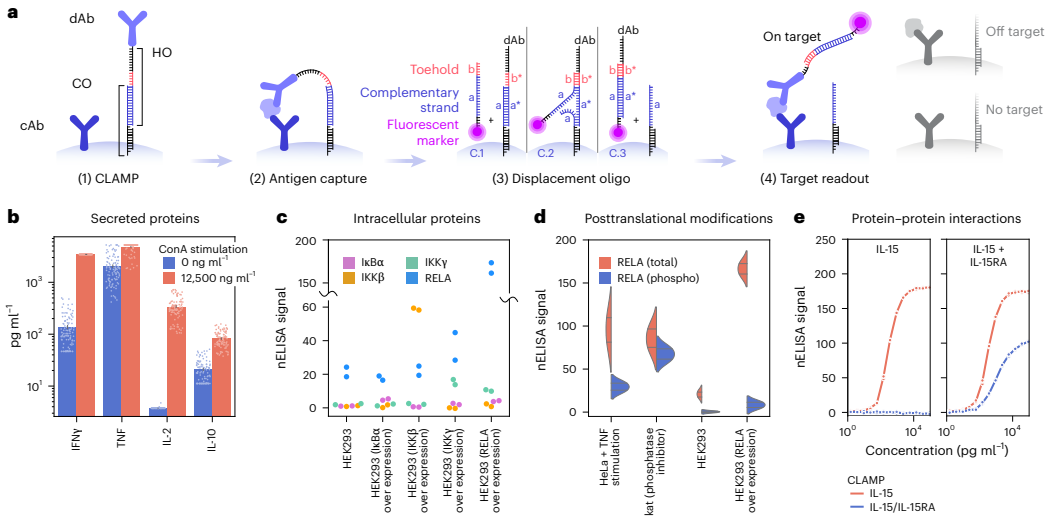
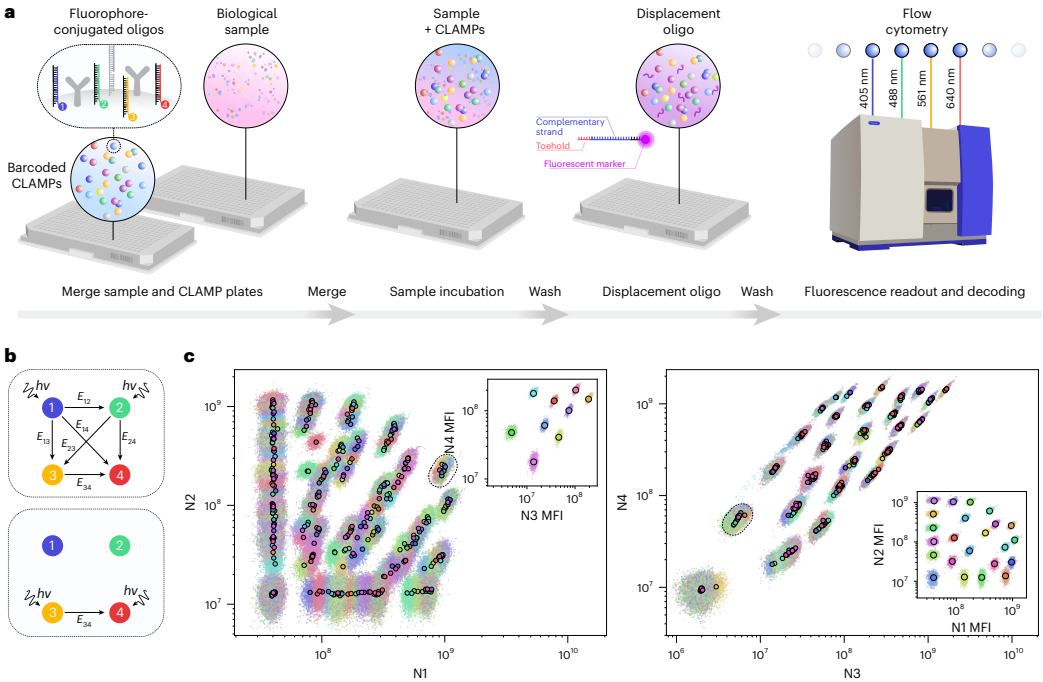
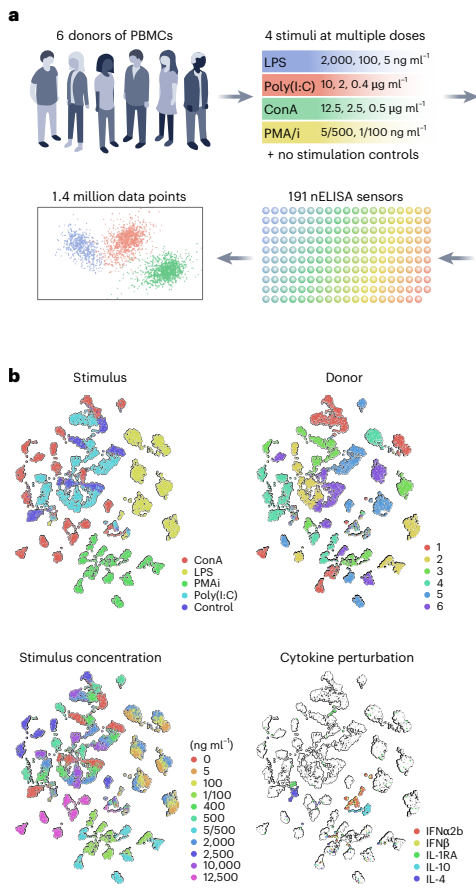
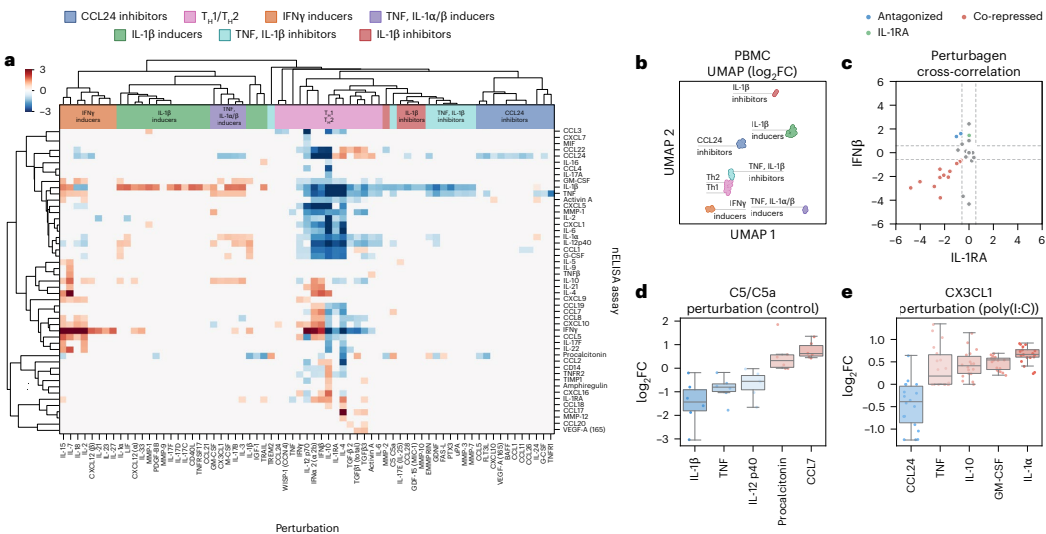
为解决现有高plex蛋白检测工具在定量准确性、精密度和成本效益方面的不足,研究人员开发了nELISA平台。该技术通过DNA介导的微珠夹心免疫分析法结合多色微珠条形码技术,成功构建191-plex炎症因子检测面板,在7,392个PBMC样本中生成140万组蛋白测量数据,灵敏度达亚皮克/毫升级,为大规模表型筛选提供了高效解决方案。
 生物通微信公众号
生物通微信公众号
生物通 版权所有