编辑推荐:
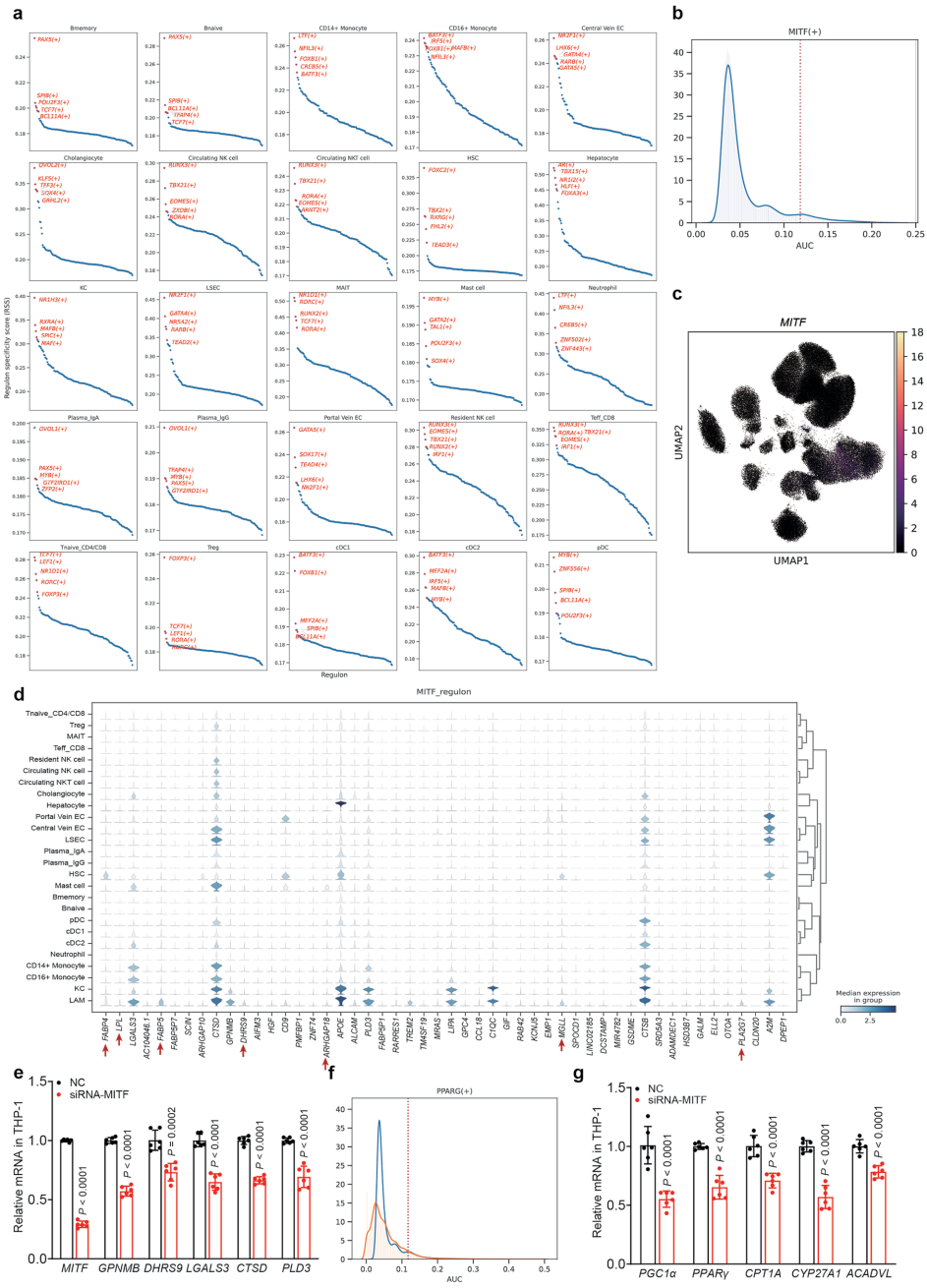
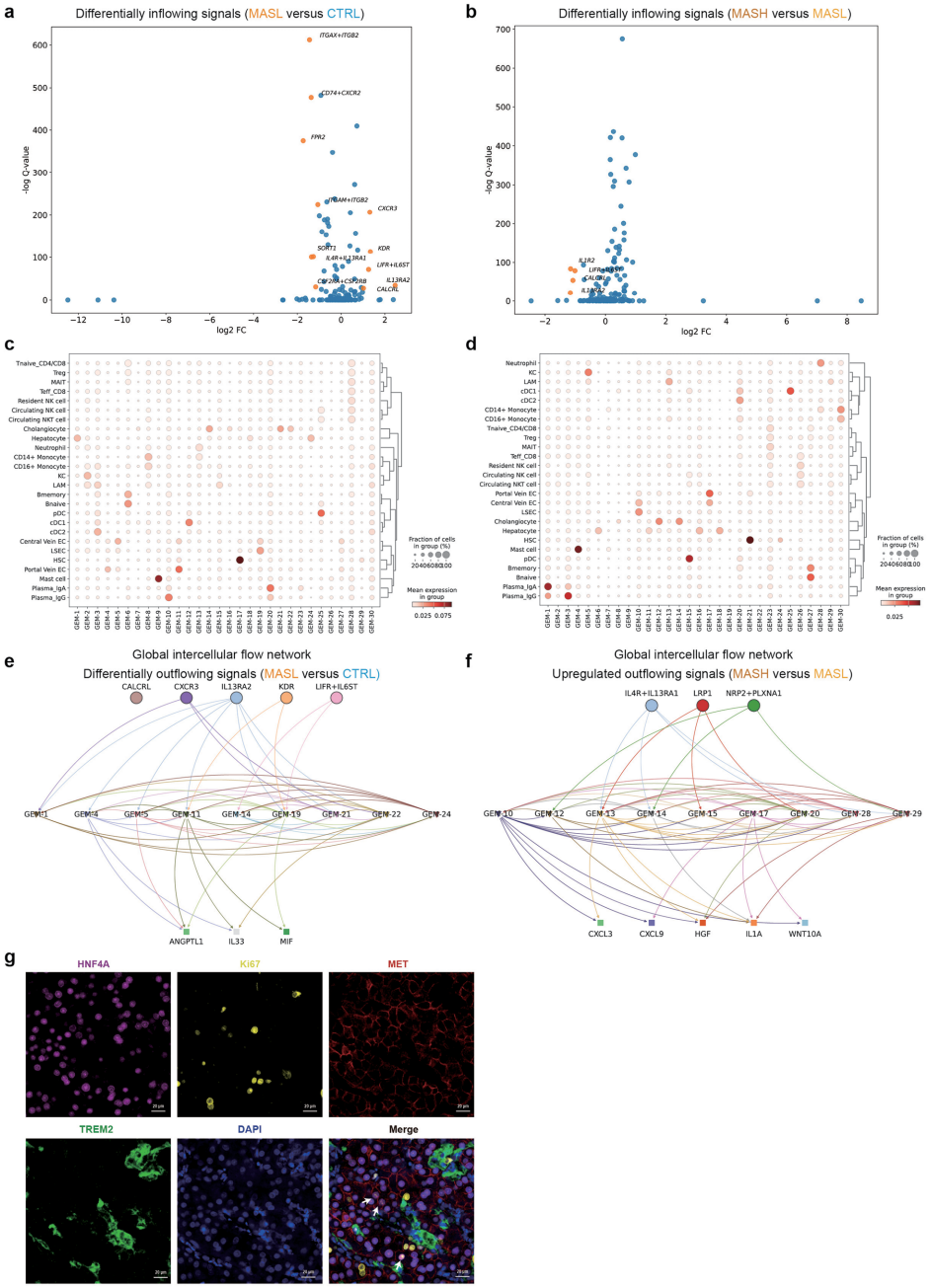
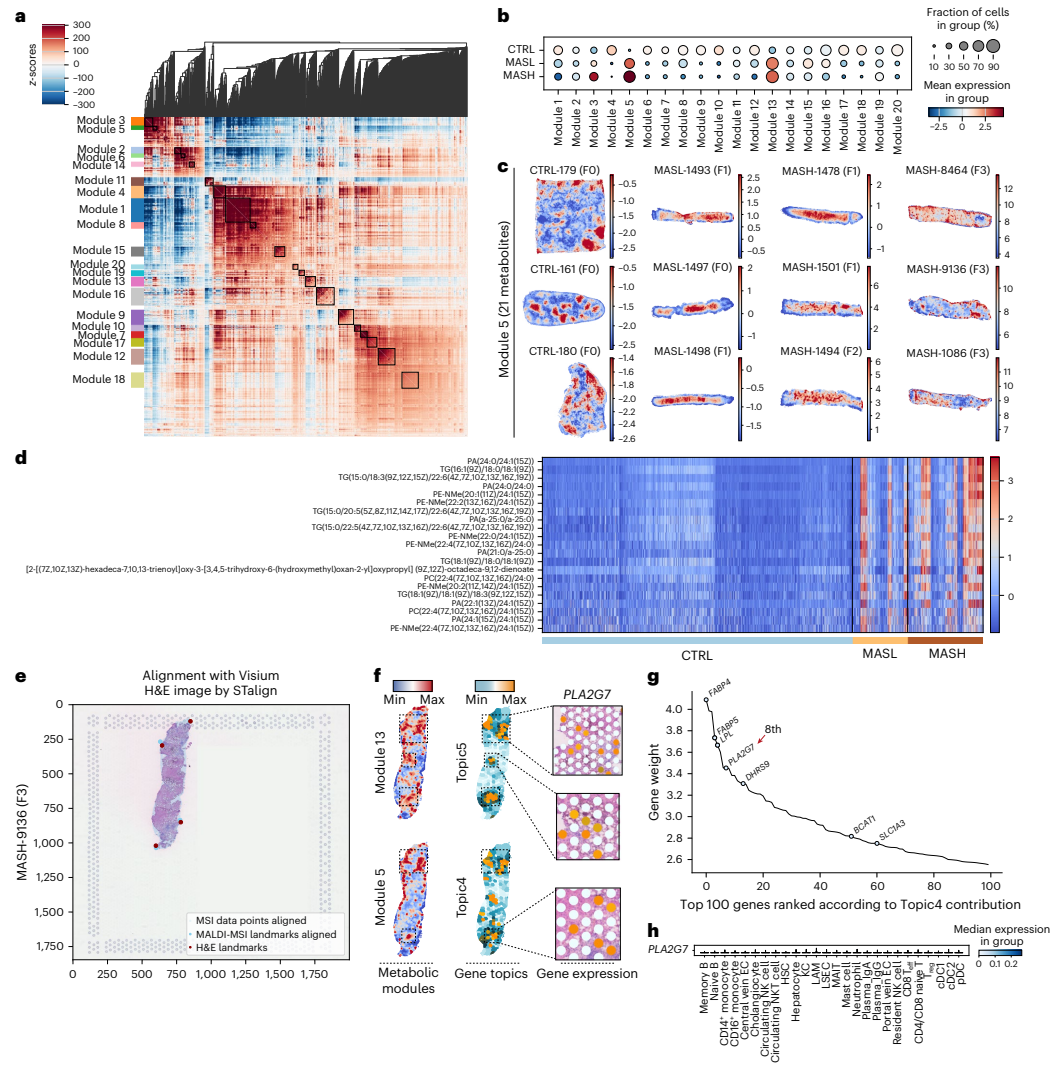
本研究通过单细胞转录组、空间转录组和空间代谢组等多组学技术,对61例人类代谢功能障碍相关脂肪性肝病(MASLD)样本进行系统性分析。研究人员发现微眼转录因子(MITF)是脂质相关巨噬细胞(LAMs)脂质处理能力的关键调控因子,并揭示LAMs通过肝细胞生长因子(HGF)分泌发挥肝保护作用。空间转录组分析识别出晚期MASH富集的纤维化相关基因程序,质谱成像技术进一步证实MASLD特异性磷脂积聚与Lp-PLA2介导的磷脂代谢相关。该研究为MASLD机制研究和治疗策略开发提供了宝贵资源。
生物通 版权所有