编辑推荐:
北京大学团队通过单细胞RNA测序(scRNA-seq)发现子宫腺肌症患者子宫内膜中存在高表达催乳素受体(PRLR)的ECM-high上皮细胞亚群,证实局部PRL-PRLR信号过度激活驱动病灶形成。研究利用转基因小鼠和垂体移植模型验证病理机制,并证明单抗HMI-115靶向抑制PRLR可显著改善疾病,为保留生育力的治疗提供新策略。
子宫腺肌症作为一种常见的妇科疾病,困扰着全球数千万育龄女性。患者不仅饱受痛经、月经过多和慢性盆腔痛的折磨,还面临不孕的困境。目前临床主要采用激素疗法或子宫切除术,但这些方法要么伴随骨质疏松、潮热等严重副作用,要么直接剥夺患者的生育能力。更令人担忧的是,过去几十年间该疾病的药物研发几乎停滞,根本原因在于对其发病机制认识不足。
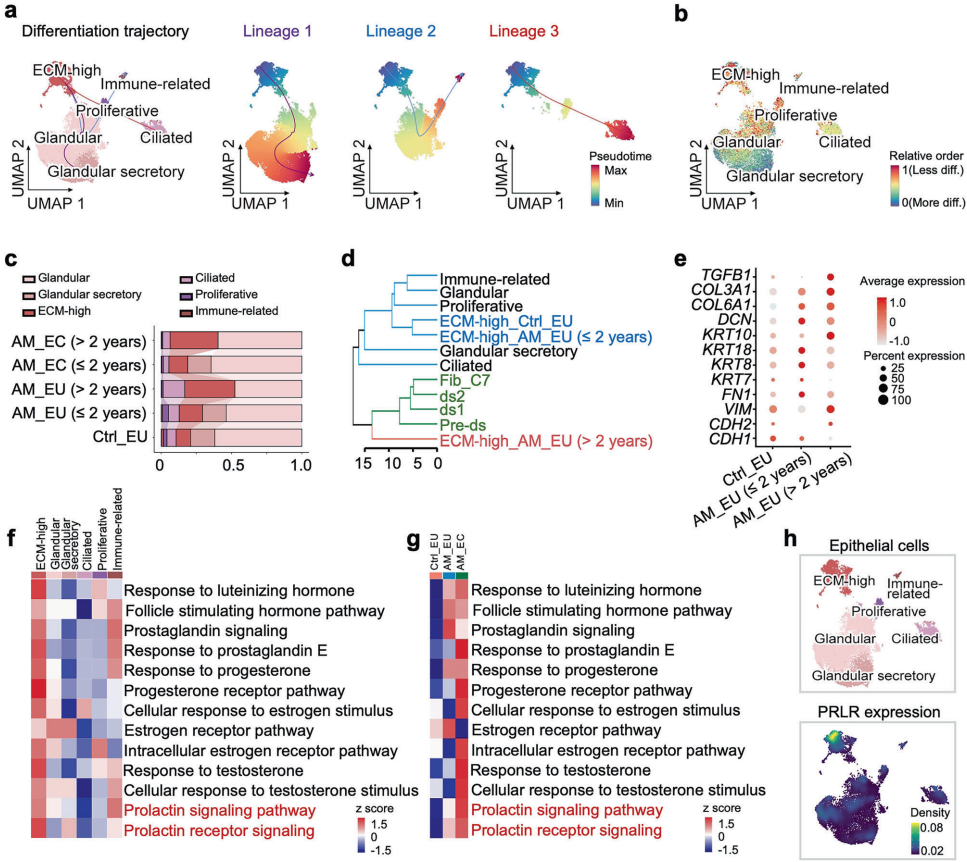
为破解这一难题,北京大学的研究团队独辟蹊径,运用单细胞RNA测序(scRNA-seq)技术对患者子宫内膜组织进行高精度解析。他们发现了一群具有独特表型的ECM-high上皮细胞——这些细胞同时表达上皮标志物EPCAM和成纤维细胞标志物DCN,在腺肌症病灶中显著扩增。进一步分析揭示,催乳素受体(PRLR)在此细胞亚群中特异性高表达,其介导的信号通路过度激活可促进细胞增殖并抑制凋亡,成为驱动病灶形成的关键机制。
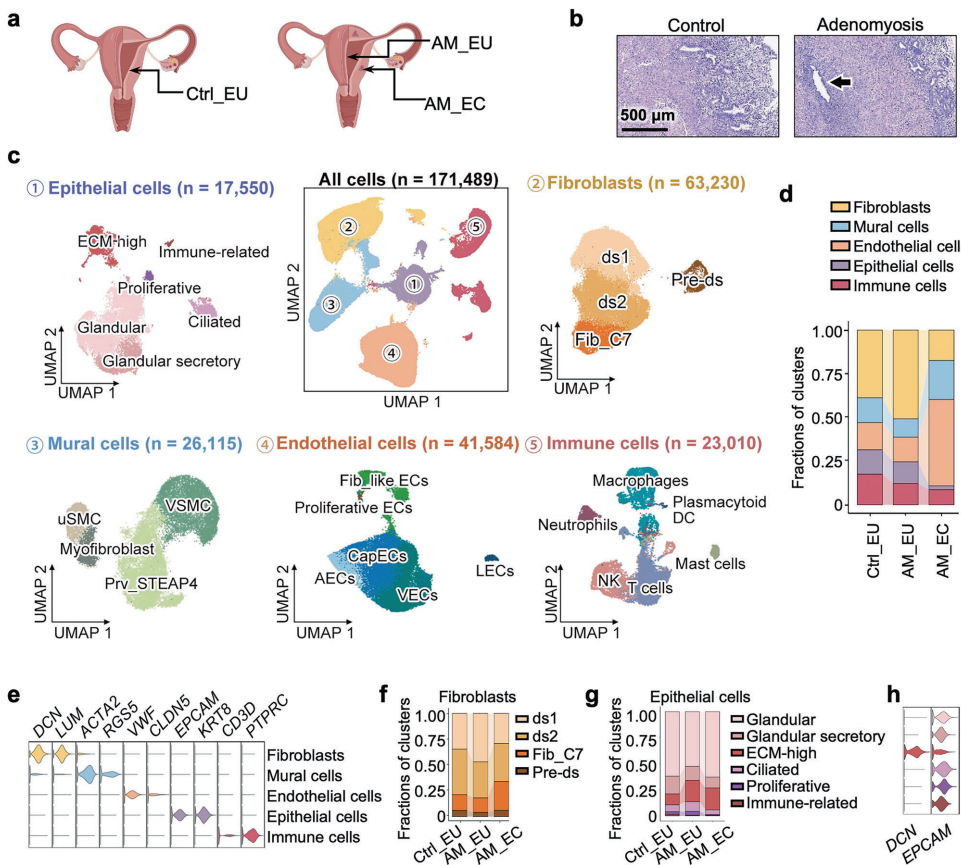
研究采用多组学技术验证这一发现:免疫组化显示患者病灶PRLR表达升高而血清PRL水平正常;RNA原位杂交证实EPCAM+DCN+双阳性细胞存在于肌层。体外实验证明PRL能以剂量依赖方式促进子宫内膜上皮细胞增殖,并显著抑制阿霉素诱导的caspase-3/7活化。
团队还发现另一群高表达PRLR的ds1成纤维细胞亚群,其炎症相关基因显著富集。PRL刺激可诱导培养的子宫内膜基质细胞产生大量炎性细胞因子,这解释了腺肌症常见的纤维化和炎症微环境。
为建立因果关系,研究人员构建了PRL转基因小鼠模型,发现80%小鼠在12月龄时自发形成腺肌症。更巧妙的是,通过将垂体移植至子宫角(UPT模型)或肾包膜(RPT模型),证实局部而非全身性PRL信号异常才是致病关键——UPT模型小鼠全部在6个月内发病,而RPT模型仅少数出现病变。
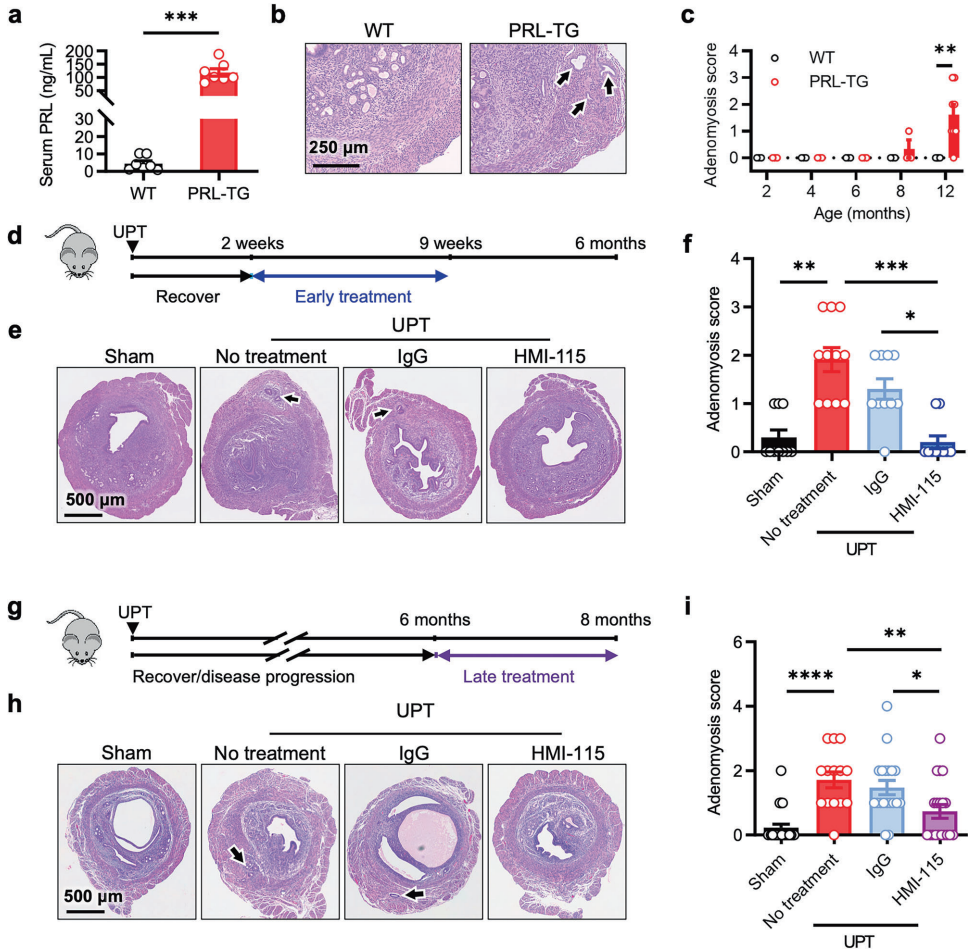
治疗方面,无论是疾病早期(移植后2周)还是已形成病灶(移植后6个月)时给予PRLR单抗HMI-115,都能显著减轻病理改变。这种靶向治疗不改变子宫重量和全身激素水平,为保留生育功能提供了可能。
该研究首次通过单细胞精度绘制了腺肌症的细胞图谱,锁定PRLR为关键治疗靶点。相比传统激素疗法,HMI-115靶向阻断策略避免了全身内分泌干扰,其临床转化潜力已在I期试验中得到初步验证。论文发表于《Signal Transduction and Targeted Therapy》,为这个长期被忽视的妇科疾病带来了突破性治疗希望。
主要技术方法:研究对13例分泌期子宫样本(7例对照和6例患者配对样本)进行10x Genomics单细胞RNA测序,共分析171,489个细胞。建立PRL转基因小鼠和垂体移植模型,采用免疫组化、RNAscope原位杂交、TUNEL凋亡检测等技术验证机制,并通过HMI-115抗体进行干预研究。
研究结果:
Identification of ECM-high epithelial cells in endometrial tissue
单细胞测序发现腺肌症患者子宫内膜中ECM-high上皮细胞比例显著增加,该亚群同时表达上皮和成纤维细胞标志物。
Pathological alterations in ECM-high epithelial cells in adenomyosis
病程超过2年的患者ECM-high细胞呈现更强的成纤维细胞特征,分化轨迹分析显示其具有多向分化潜能。
Enhanced PRL signaling promotes the proliferation and survival of endometrial epithelial cells
PRLR在病灶中特异性高表达,PRL通过激活STAT信号促进上皮增殖并抑制凋亡,RNAscope证实EPCAM+DCN+PRLR+三阳性细胞存在于肌层。
Role of fibroblasts in promoting uterine inflammation, fibrosis, and structural disruption in adenomyosis
ds1成纤维细胞亚群呈现最强炎症特征,PRL刺激可诱导IL-6等炎性因子分泌,Fib_C7亚群比例增加导致基底膜结构破坏。
Enhanced prolactin signaling drives adenomyosis development
PRL转基因小鼠自发形成腺肌症,子宫局部PRL暴露(UPT模型)比全身性升高(RPT模型)更易诱发疾病。
Blocking PRL signaling alleviates adenomyosis
HMI-115治疗显著降低疾病发生率和严重程度,且不影响生殖系统发育。
这项研究从根本上改变了我们对腺肌症发病机制的理解,首次证实局部PRL-PRLR信号异常是疾病发生的核心环节。从临床角度看,HMI-115为代表的靶向疗法有望打破现有治疗困境,其保留生育功能的特性尤其适合年轻患者。未来研究可进一步优化给药方案,并探索与其他靶向药物的联合治疗策略。
 生物通微信公众号
生物通微信公众号
生物通 版权所有