编辑推荐:
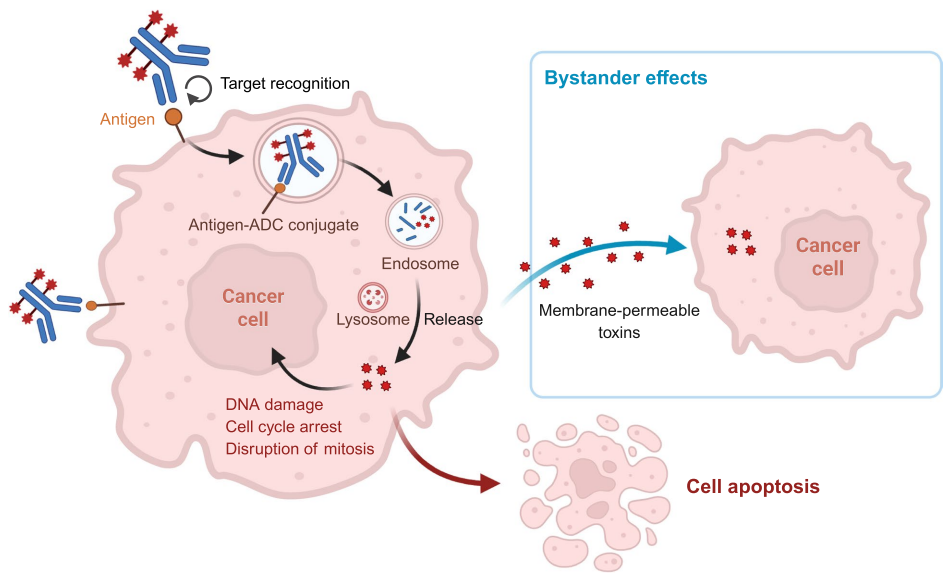
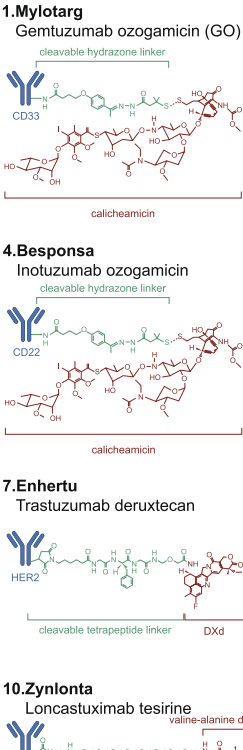
本综述系统阐述了抗体药物偶联物(ADC)从分子设计到临床转化的最新进展。文章深入解析了ADC的三大结构元件(抗体、连接子、有效载荷)及其对药代动力学和治疗指数的影响,重点探讨了针对血液肿瘤和实体瘤的15款FDA批准ADC的临床效益与毒性管理策略。作者前瞻性地指出,双特异性ADC、免疫刺激载荷和人工智能辅助设计等创新技术将推动下一代ADC的发展,为精准肿瘤治疗提供新范式。
 生物通微信公众号
生物通微信公众号
生物通 版权所有