编辑推荐:
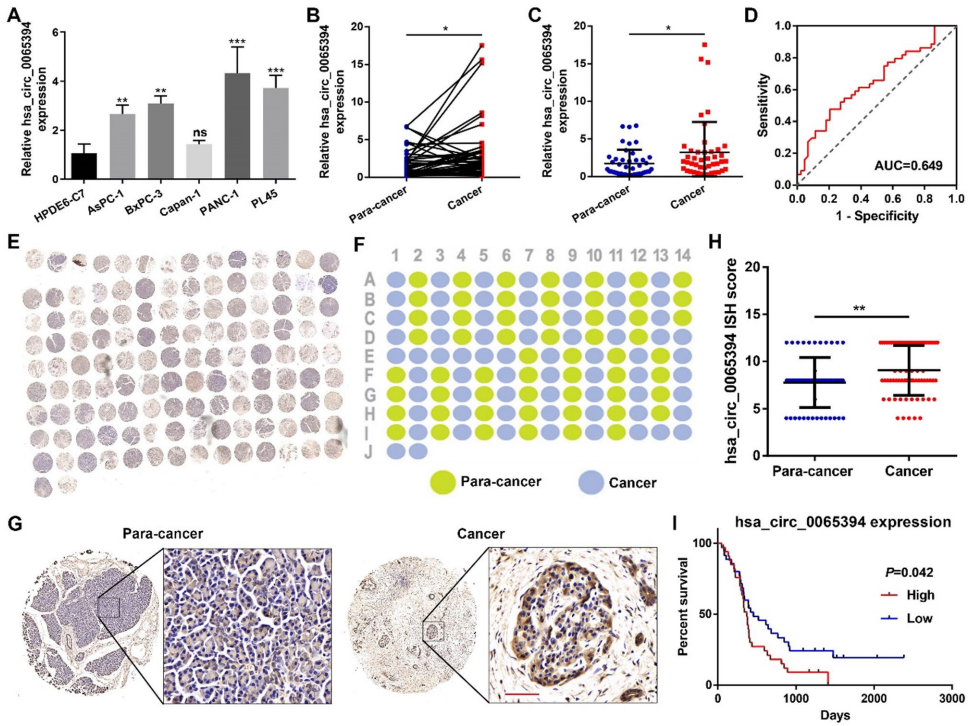
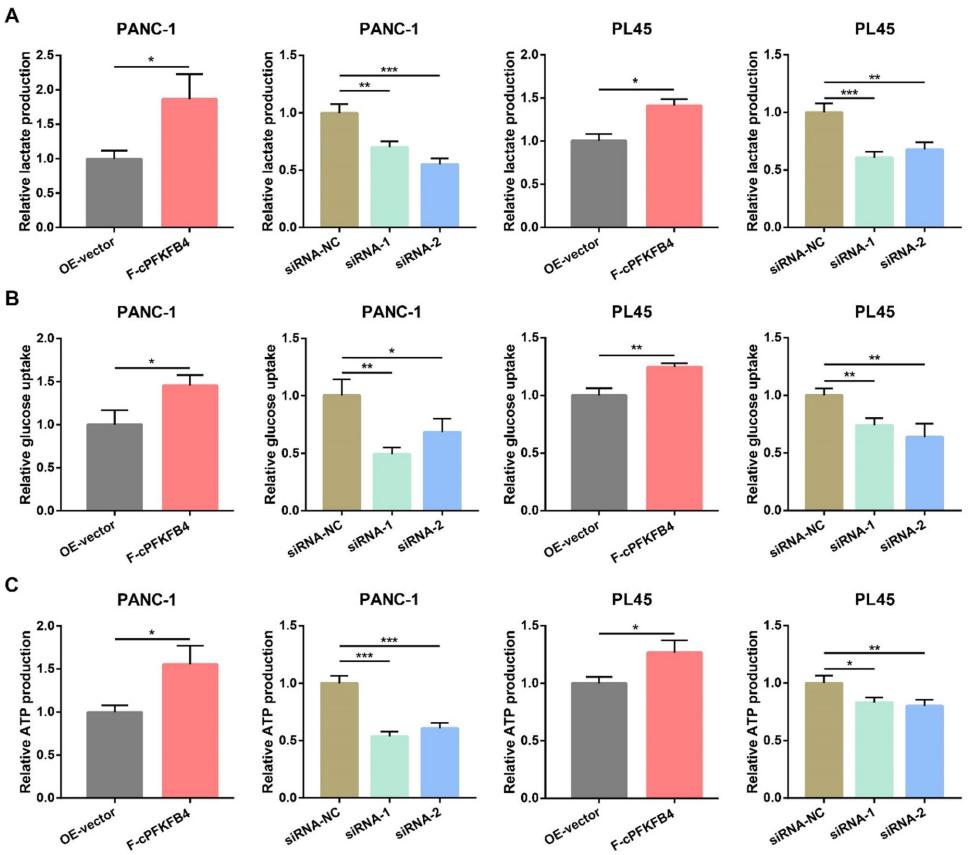
本研究针对胰腺癌缺氧微环境中葡萄糖代谢重编程的调控机制,发现缺氧诱导的环状RNA hsa_circ_0065394编码新型蛋白cPFKFB4,通过破坏hnRNP G/hnRNP A1复合物增强PKM2选择性剪接,进而强化糖酵解并驱动肿瘤恶性进展。该研究为缺氧微环境与代谢重编程的交叉调控提供了新视角,为胰腺癌治疗提供了潜在靶点。







 生物通微信公众号
生物通微信公众号
生物通 版权所有