编辑推荐:
本刊推荐:EBV相关鼻咽癌(NPC)为何对PD-1/PDL1抑制剂响应率仅20%?美国俄亥俄州立大学团队发现miR-155通过双重抑制ICOSL(可诱导T细胞共刺激配体)和MHC-I(主要组织相容性复合体I类分子),使肿瘤微环境中大量浸润的CD8+ T细胞成为"挫败T细胞",揭示了EBV通过表观遗传调控实现免疫逃逸的新范式,为联合靶向miR-155与ICOSL的疗法提供理论依据。
鼻咽癌(NPC)作为与EB病毒(EBV)密切相关的恶性肿瘤,呈现出独特的"免疫悖论":尽管肿瘤微环境中存在大量细胞毒性CD8+
T细胞浸润,但免疫检查点抑制剂的失败率高达70-80%。这种矛盾现象背后隐藏着EBV操纵宿主免疫系统的精妙机制,成为肿瘤免疫治疗研究的关键科学问题。
美国俄亥俄州立大学综合癌症中心的Gerard J. Nuovo、Esmerina Tili和Carlo M. Croce团队在《Signal Transduction and Targeted Therapy》发表的研究,首次系统揭示了EBV通过上调miR-155同时抑制ICOSL(Inducible T-cell costimulator ligand)和MHC-I(Major Histocompatibility Complex class I)的双重免疫逃逸机制。研究人员采用9例EBV阳性NPC临床样本,通过多色荧光原位杂交(ISH)和免疫组织化学(IHC)技术,结合共定位分析,发现EBV感染的癌细胞特异性高表达miR-155与PDL1,却显著缺失ICOSL和MHC-I表达。
关键实验技术:研究团队主要采用:1)原位杂交检测EBER-1/2和miR-155共表达;2)免疫组化分析ICOSL、MHC-I、PDL1和CD3/ICOS的蛋白定位;3)多色荧光共定位技术验证分子相互作用。样本来源于Folio Biosciences的福尔马林固定石蜡包埋活检组织。
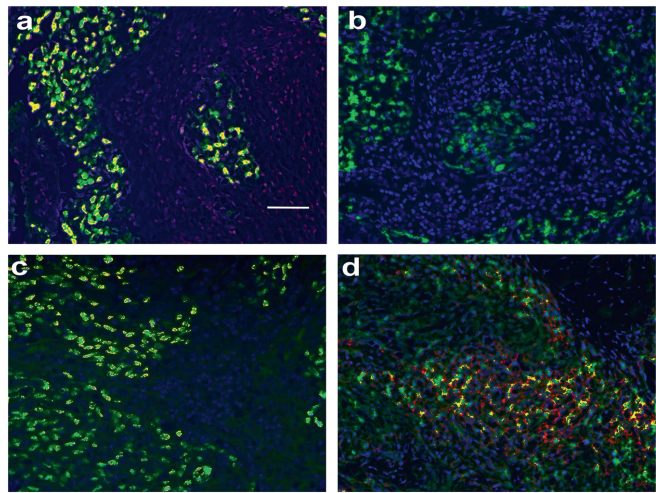
EBV诱导miR-155特异性表达于癌细胞
通过双色ISH技术,研究发现所有9例NPC标本中,EBER-1/2阳性癌细胞(荧光绿)与miR-155(荧光蓝)呈现完全共定位(荧光黄),而周围单核细胞和正常上皮均不表达miR-155。
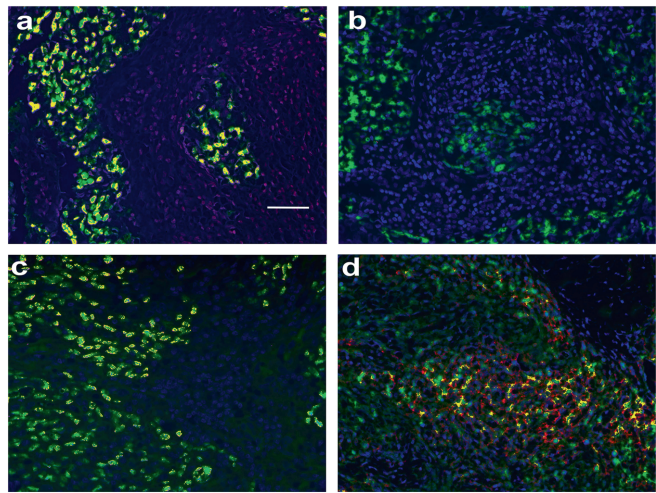
免疫识别关键分子丢失
与相邻正常鼻咽组织(MHC-I强阳性)形成鲜明对比,EBER-1/2阳性癌细胞几乎完全缺失MHC-I(荧光红)和ICOSL表达。
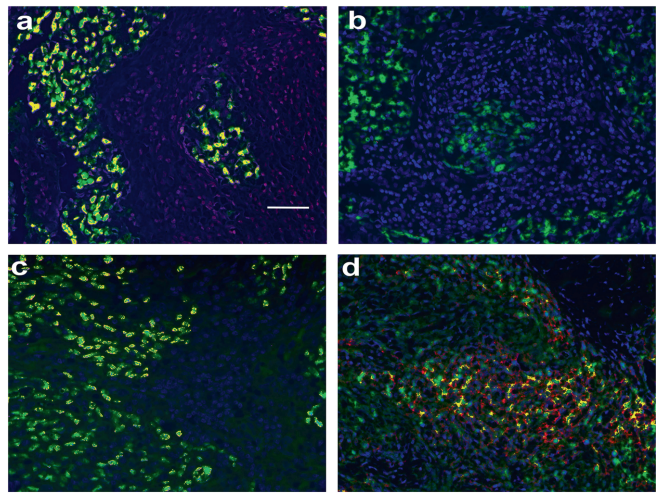
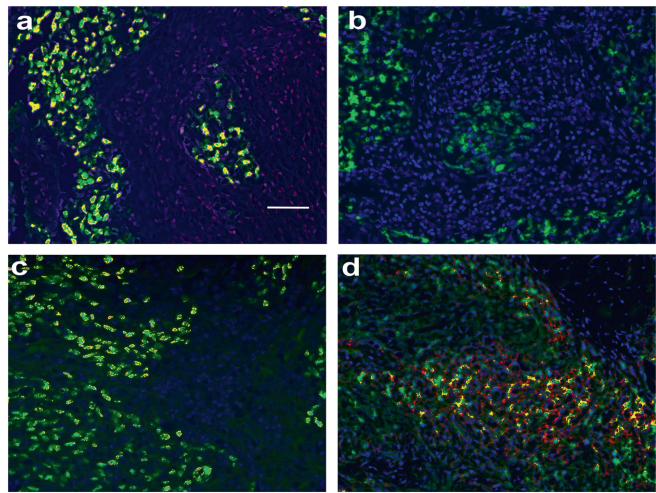
"挫败T细胞"现象
肿瘤浸润淋巴细胞中,CD3+
T细胞(荧光红)普遍表达ICOS(荧光绿),形成显著共定位(荧光黄)。
结论与意义
该研究揭示EBV通过miR-155同时抑制ICOSL和MHC-I的"双靶点抑制"策略,即使面对大量浸润的细胞毒性T细胞,肿瘤细胞仍能实现免疫逃逸。这一发现解释了为何PD1/PDL1抑制剂在NPC中疗效有限——单纯的检查点阻断无法解决抗原提呈(MHC-I)和共刺激信号(ICOSL)的双重缺陷。研究提出了联合靶向治疗的新思路:通过抑制miR-155恢复ICOSL和MHC-I表达,可能重新激活"挫败T细胞"的杀伤功能。
该工作不仅为NPC免疫治疗抵抗提供了机制解释,更揭示了病毒相关肿瘤中miRNA介导的免疫调控网络复杂性。鉴于miR-155在抗病毒和抗肿瘤免疫中的双重作用,研究强调需要开发时空特异性调控策略,为EBV相关恶性肿瘤的精准免疫治疗奠定理论基础。
 生物通微信公众号
生物通微信公众号
生物通 版权所有