编辑推荐:
本研究针对急性胰腺炎(AP)伴随的糖代谢紊乱难题,通过生物信息学筛选发现PFKFB3是关键调控靶点。研究人员创新性采用AR42J细胞源纳米囊泡(Q-Ex)递送槲皮素抑制剂,证实其可有效抑制PFKFB3介导的糖酵解通路,在细胞和动物模型中同步改善炎症反应和代谢异常。该研究为AP治疗提供了兼具靶向性和生物相容性的新型递药系统,发表于《Molecular Medicine》。
急性胰腺炎(AP)作为消化系统常见的炎症性疾病,其严重病例常伴随致命的代谢并发症。尽管临床治疗不断进步,但糖代谢紊乱这一"隐形杀手"仍是影响预后的关键因素。研究表明,AP患者中异常的糖酵解过程会加剧炎症风暴,形成恶性循环,然而其分子机制犹如"黑箱",缺乏有效的干预手段。这一困境激发了研究者对代谢-炎症轴关键节点的探索欲望。
蚌埠医学院第一附属医院急诊外科团队在《Molecular Medicine》发表的研究,犹如打开这个黑箱的钥匙。通过整合生物信息学分析和创新性纳米递药技术,发现6-磷酸果糖-2-激酶/果糖-2,6-二磷酸酶3(PFKFB3)是调控AP糖代谢紊乱的核心开关,并成功开发出基于细胞膜纳米囊泡的靶向治疗策略。
研究采用多组学联用技术:首先通过GEO数据库获取87例AP患者和32例健康对照的转录组数据,运用加权基因共表达网络分析(WGCNA)和基因集富集分析(GSEA)筛选关键模块;结合单细胞RNA测序(scRNA-seq)数据GSE250486进行细胞亚群解析;采用差速离心法从AR42J胰腺腺泡细胞分离细胞外囊泡(EVs),通过电穿孔技术负载槲皮素构建Q-Ex纳米递药系统;最后通过脂多糖(LPS)诱导的RAW264.7巨噬细胞炎症模型和雨蛙素诱导的大鼠AP模型验证治疗效果。
GSEA联合免疫浸润揭示AP参与炎症反应
分析显示AP组显著富集于糖酵解和PPAR信号通路,免疫微环境呈现CD4+ T细胞、CD8+ T细胞和巨噬细胞的动态变化。单细胞图谱揭示AP中巨噬细胞比例显著增加,细胞间通讯分析显示其成为炎症网络的"枢纽"。
关键基因筛选发现PFKFB3核心作用
WGCNA鉴定出与AP最相关的brown4模块(相关系数0.46),差异表达基因(DEGs)分析获得118个上调基因。关键基因交叉筛选锁定18个特征基因,其中PFKFB3在巨噬细胞中表达差异最显著,且与果糖代谢通路密切关联。

纳米囊泡递送PFKFB3抑制剂
透射电镜显示制备的EVs直径约85nm,动态光散射(DLS)证实Q-Ex粒径为86.2±6.5nm。高效液相色谱(HPLC)分析显示纳米包裹使槲皮素溶解度提升3倍,血清中可稳定存在7天以上。

Q-Ex体外抗炎与代谢调控
荧光标记证实Q-Ex增强细胞摄取效率。在LPS诱导的巨噬细胞中,Q-Ex使PFKFB3蛋白水平降低67%,同时抑制肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)等炎症因子分泌。 Seahorse分析显示Q-Ex使氧消耗率(OCR)提升2.1倍,而细胞外酸化率(ECAR)降低58%,表明糖酵解过程受抑。
动物模型验证治疗效果
在大鼠AP模型中,Q-Ex治疗使胰腺病理评分下降72%,血清淀粉酶水平降低65%。免疫组化显示胰腺组织PFKFB3表达减少81%,同时关键糖酵解酶GLUT1、HK1等表达显著下调。8-羟基脱氧鸟苷(8-OHdG)免疫荧光显示氧化应激水平降低54%。
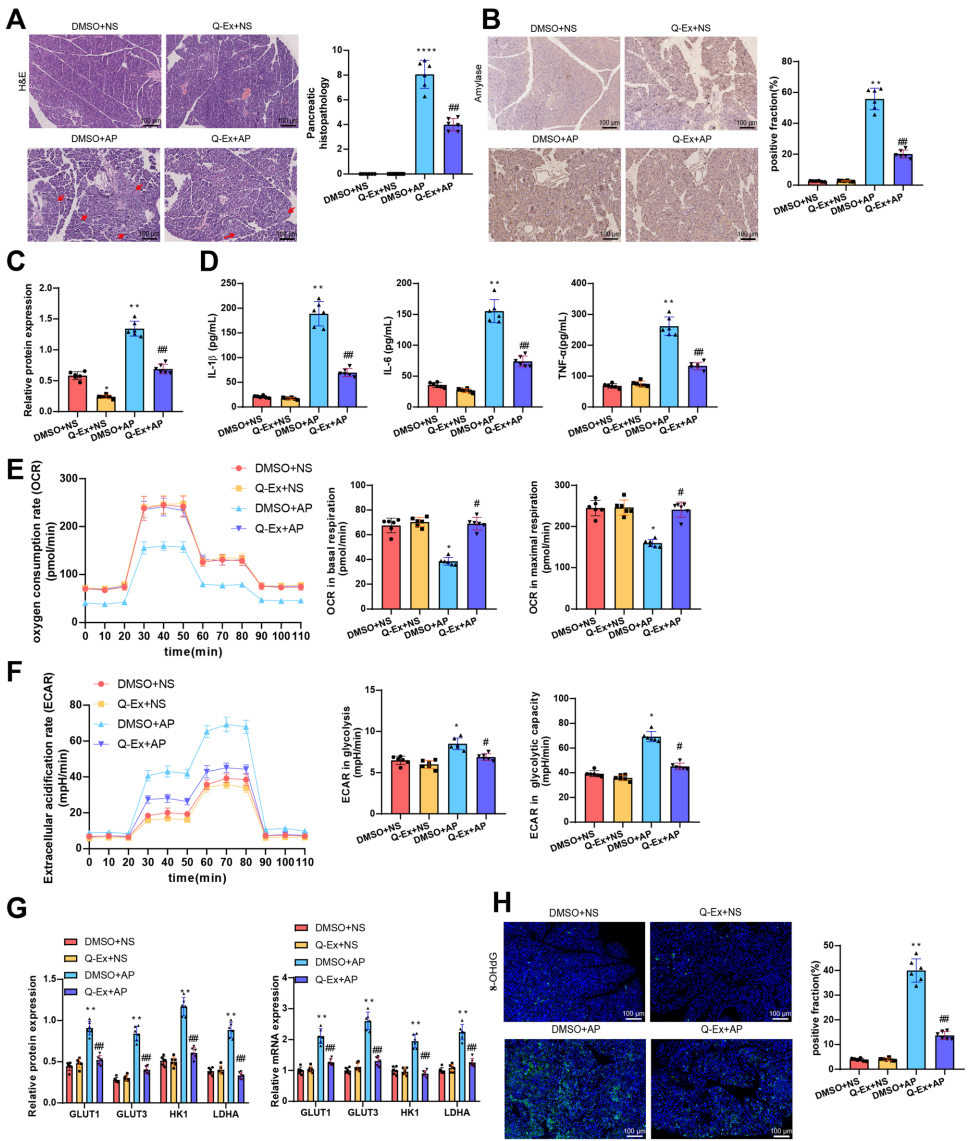
这项研究开创性地将纳米囊泡技术与代谢调控相结合,解决了AP治疗中药物靶向性差和代谢干预缺失的双重难题。通过多组学分析揭示PFKFB3是连接炎症与代谢的关键节点,而基于EVs的递药系统突破传统槲皮素溶解性差的限制。实验证实Q-Ex能同时"刹车"炎症反应和糖酵解亢进,这种"双管齐下"的作用机制为AP治疗提供新范式。值得注意的是,该策略对巨噬细胞代谢重编程的特异性调控,可能拓展至其他炎症性疾病的应用。未来研究可进一步优化囊泡的靶向修饰,并探索PFKFB3异构体选择性的抑制剂,以提升治疗精准度。这项成果标志着代谢干预在AP治疗领域的重要突破,为临床转化奠定坚实基础。
 生物通微信公众号
生物通微信公众号
生物通 版权所有