编辑推荐:
本研究针对创伤后应激障碍(PTSD)现有药物治疗缓解率低(仅20-30%)的临床困境,通过多模态临床研究结合动物模型,首次揭示前额叶星形胶质细胞单胺氧化酶B(MAOB)依赖性γ-氨基丁酸(GABA)失调是PTSD的核心病理机制。研究发现可逆性MAOB抑制剂KDS2010能有效恢复GABA稳态并改善恐惧消退记忆,已完成Ⅰ期临床试验,为PTSD提供了首个靶向星形胶质细胞机制的转化治疗方案。
创伤后应激障碍(PTSD)如同大脑中挥之不去的警报系统,患者即使脱离危险环境,仍会持续经历创伤记忆的闪回和过度警觉。现有仅有的两种5-羟色胺受体靶向药物疗效有限,仅能使不足三分之一的患者获得完全缓解。更棘手的是,临床前研究长期聚焦神经元机制,而调控恐惧记忆的关键脑区——前额叶皮层(PFC)的功能异常始终缺乏精准干预靶点。
韩国梨花女子大学(In Kyoon Lyoo团队)与基础科学研究所(C. Justin Lee团队)的跨国合作研究打破了这一僵局。研究人员通过6项系统研究,首次揭示星形胶质细胞(astrocyte)异常释放的γ-氨基丁酸(GABA)才是PTSD"神经锁死"现象的关键推手。这项发表于《Signal Transduction and Targeted Therapy》的研究,不仅阐明了MAOB-GABA通路的致病机制,更带来了已进入Ⅱ期临床的可逆性抑制剂KDS2010,为PTSD治疗开辟了靶向神经胶质的新纪元。
研究采用多学科交叉技术:1) 248人队列的磁共振波谱('H-MRS)和动脉自旋标记(ASL)检测前额叶GABA与脑血流量;2) PTSD患者尸检脑组织的RNA测序和免疫染色;3) 条件恐惧联合单次延长应激(SPS)的小鼠模型;4) 星形胶质细胞特异性MAOB基因操作;5) 激光多普勒血流仪(LDF)记录神经血管耦合;6) 膜片钳记录紧张性GABA电流。
【前额叶GABA改变通过脑血流量调节影响PTSD症状严重度】
临床横断面研究显示,持续PTSD患者前额叶GABA水平较健康对照组显著升高1.5倍,而康复者GABA恢复正常。这种升高与前额叶脑血流量(CBF)降低呈强负相关,且中介分析证实CBF下降是GABA导致症状加重的关键环节。
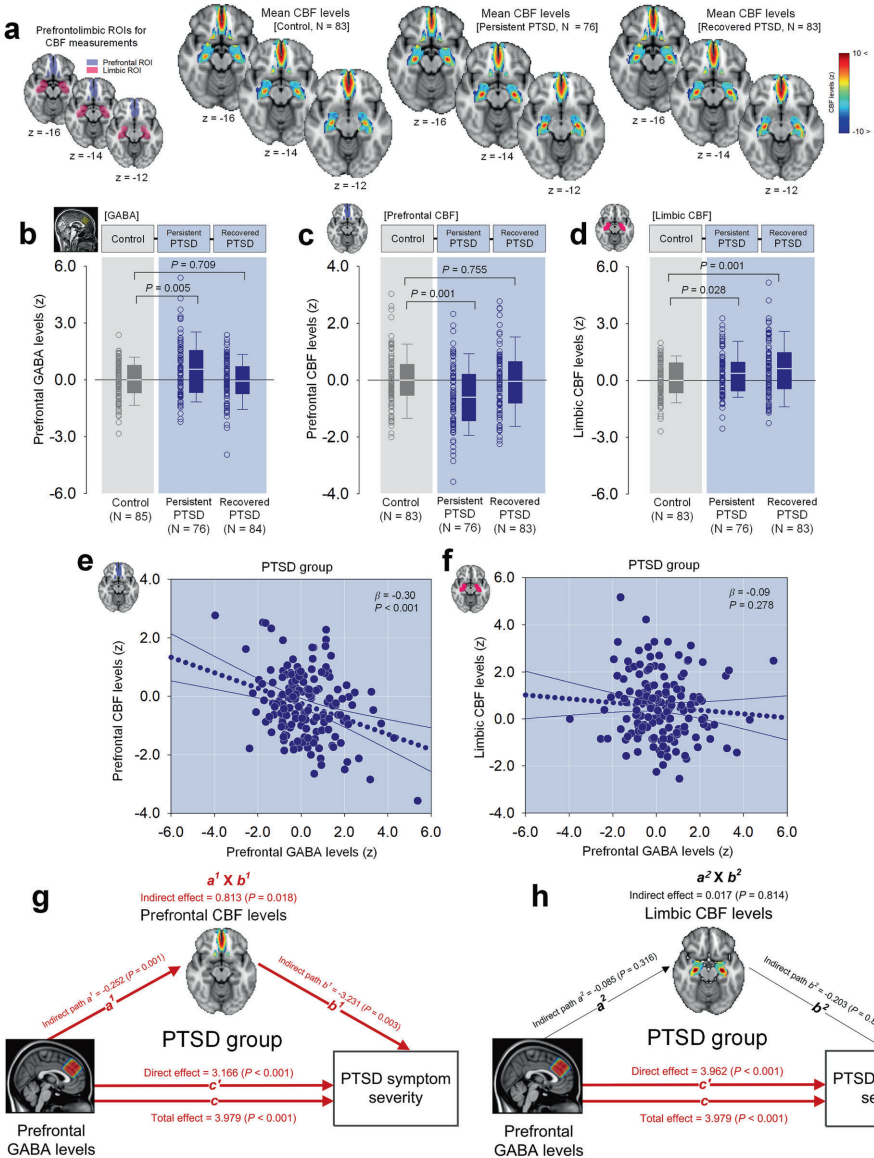
【前额叶GABA正常化与PTSD症状改善相关】
纵向研究追踪65名创伤暴露者8个月,发现症状改善者的GABA水平随时间显著降低,且这种降低与临床医生用PTSD量表(CAPS)评分改善直接相关,证实GABA动态变化是疾病活动的生物标志物。
【PTSD患者死后脑组织前额叶星形胶质细胞GABA改变】
尸检脑组织显示,PTSD患者星形胶质细胞标志物GFAP和MAOB表达上调2-3倍,S100β+区域内GABA强度增加40%,伴随4-氨基丁酸氨基转移酶(ABAT)降解酶减少。Sholl分析揭示反应性星形胶质细胞的复杂分支增加,印证"过度活跃"的病理状态。
【PTSD样小鼠模型IL皮层星形胶质细胞变化与GABA升高】
小鼠模型完美复现人类特征:MAOB依赖的星形胶质细胞GABA合成增加,同时ABAT介导的降解减少。膜片钳记录显示紧张性GABA电流增强2倍,而突触GABA电流不变,证实异常抑制源自星形胶质细胞。
【IL星形胶质细胞MAOB是恐惧消退记忆缺陷的必要充分条件】
基因操作实验显示,特异性敲低内侧前额叶皮层下边缘区(IL)而非前边缘区(PL)的星形胶质细胞MAOB,可使小鼠恐惧消退记忆恢复80%。过表达实验则再现PTSD表型,确立MAOB-GABA轴的因果地位。
【MAOB抑制剂KDS2010在PTSD样小鼠模型中的药理抑制】
可逆性MAOB抑制剂KDS2010处理9天,不仅使星形胶质细胞形态恢复正常,更完全逆转恐惧记忆缺陷和工作记忆障碍。激光多普勒证实其可修复NMDA刺激引起的CBF反应障碍,这种改善与紧张性GABA电流降低同步。
这项研究构建了从分子机制到临床转化的完整证据链:MAOB通过"合成增加-降解减少"双重机制导致星形胶质细胞GABA过度释放,产生的紧张性抑制会"锁死"前额叶皮层神经元活动,既阻碍恐惧消退记忆形成,又通过神经血管耦合障碍加剧症状。与传统抗抑郁药靶向神经元不同,KDS2010通过精准调节星形胶质细胞代谢酶活性恢复GABA稳态,且已证明人体安全性,为PTSD提供了首个以神经胶质为靶点的临床候选药物。该发现不仅改写了对PTSD病理的认知,更开创了"代谢酶-胶质递质-神经环路"三位一体的治疗新范式。
 生物通微信公众号
生物通微信公众号
生物通 版权所有