编辑推荐:
克罗恩病(Crohn's disease, CD)患者常伴随体重减轻和肌肉萎缩等全身症状,但其机制尚未明确。本研究通过TNFDARE/+小鼠模型,首次揭示B细胞分泌的淋巴毒素LTα3通过拮抗TNF受体信号通路,在维持肠道屏障功能和体重稳态中发挥关键保护作用,而膜型LTα1β2主要促进三级淋巴组织形成。该发现为理解CD全身症状提供了新视角,并为靶向治疗策略开发奠定基础。论文发表于《Nature Immunology》。
克罗恩病(CD)是一种累及胃肠道的慢性炎症性疾病,其特征性病理改变包括回肠透壁性炎症和肠系膜淋巴组织增生。尽管抗TNF疗法已广泛应用于临床,但约30%患者出现治疗抵抗,且伴随的全身症状如体重减轻和肌肉萎缩仍缺乏有效干预靶点。更令人困惑的是,同时靶向TNF和淋巴毒素(LT)的药物治疗CD却遭遇失败,暗示这两种细胞因子在肠道炎症中可能存在复杂互作。
为解析这一科学难题,Emma C. Erlich团队在《Nature Immunology》发表的研究中,利用基因工程小鼠模型和前沿技术手段,揭示了B细胞来源的不同LT亚型在TNF驱动回肠炎中的对立作用。研究发现,可溶性LTα3通过TNFR信号通路发挥抗炎作用,而膜型LTα1β2则主要参与三级淋巴组织形成。这一发现不仅解释了既往治疗失败的机制,更为精准干预CD全身症状提供了新靶点。
研究主要采用四种关键技术:1) 骨髓嵌合体技术构建B细胞特异性缺失LTα或LTβ的TNFDARE/+小鼠模型;2) 全组织透明化三维成像分析肠系膜淋巴结构;3) 代谢笼和EchoMRI系统监测全身代谢变化;4) 单细胞RNA测序解析免疫细胞异质性。人类样本来自手术切除的CD患者肠系膜组织。
B细胞缺失适度加重局部回肠病变
通过骨髓移植构建μMT-TNFDARE/+嵌合体发现,B细胞缺失导致回肠中性粒细胞浸润增加2倍,IgA+浆细胞减少50%,但未改变调节性T细胞比例。
B细胞缺失恢复肠系膜淋巴流动
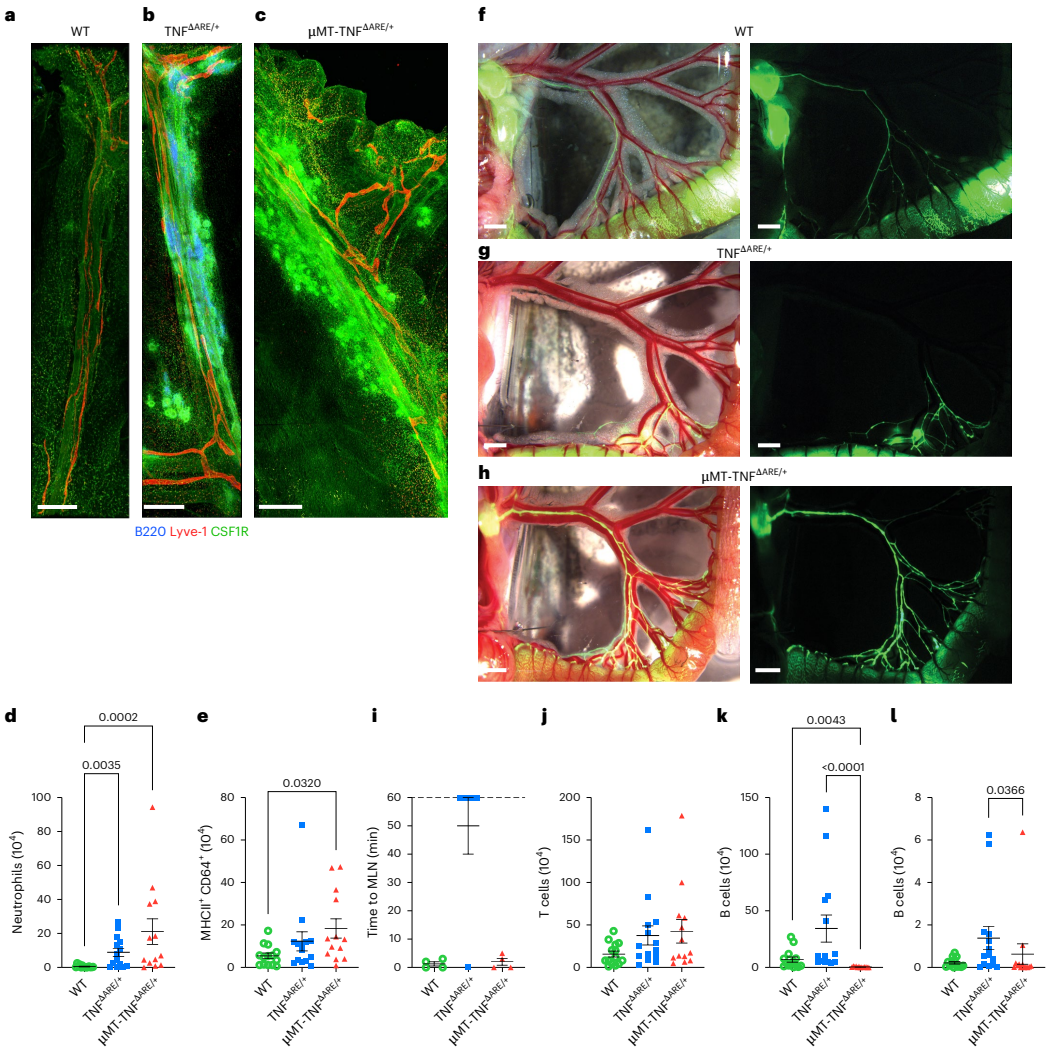
全组织成像证实B细胞聚集形成的三级淋巴组织是淋巴回流障碍的结构基础,而B细胞缺失虽恢复淋巴流动,却意外加重髓系炎症。
B细胞缺失加剧体重减轻
代谢监测显示μMT-TNFDARE/+小鼠出现显著瘦体重下降(减少12%),核心体温降低0.5℃,这与CD患者临床表现高度一致。
分泌型IgA的局部保护作用
PigR基因敲除实验证实,分泌型IgA能减少回肠免疫细胞浸润,但对体重无影响,提示B细胞存在独立于抗体的全身保护机制。
LTα与LTβ的差异化功能
基因编辑揭示B细胞LTα缺失导致:1) 肠道通透性增加2倍;2) 局部IgA+细胞减少80%;3) 体重持续下降。而LTβ缺失仅影响淋巴组织形成。
LTα3中和抗体加剧TNF效应
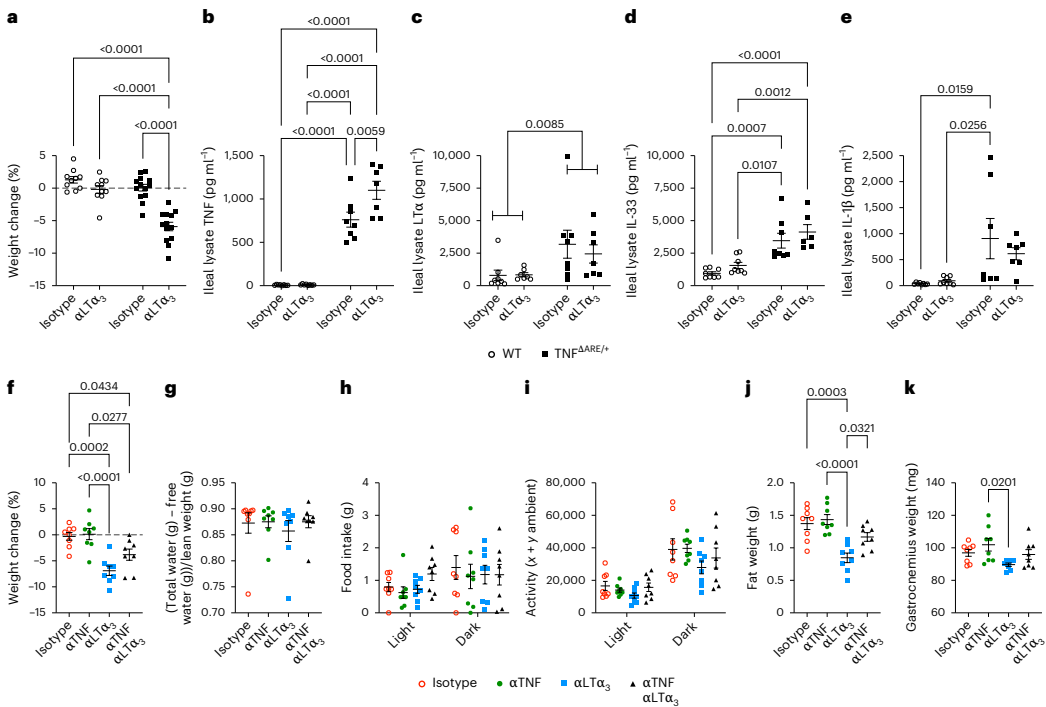
特异性中和LTα3使小鼠48小时内体重骤降5%,伴随回肠TNF水平升高3倍,证实LTα3通过拮抗TNF发挥保护作用。
单细胞解析分子机制
迁移淋巴细胞测序发现:1) LTα3中和选择性清除Lta+B细胞;2) 抗炎因子II4i1表达下调;3) IgA浆细胞前体显著减少。
这项研究首次阐明B细胞通过"双轨制"参与CD病理进程:膜型LTα1β2驱动淋巴组织增生,而可溶性LTα3则通过TNFR信号拮抗TNF的促炎和消耗效应。这一发现不仅解释了为何泛LT抑制剂治疗CD失败,更提示靶向LTα3-TNFR轴可能是改善CD全身症状的新策略。此外,研究建立的骨髓嵌合体模型为模拟CD全身表现提供了理想平台,而单细胞技术揭示的B细胞异质性为精准免疫治疗开辟了新途径。
 生物通微信公众号
生物通微信公众号
生物通 版权所有