编辑推荐:
本文系统回顾了肺癌免疫治疗领域的重要进展,聚焦于癌症疫苗(Cancer Vaccines)作为一种新兴策略,如何与免疫检查点抑制剂(Immune Checkpoint Inhibitors, ICIs)联合应用以克服现有疗法的局限性。文章深入探讨了疫苗的作用机制,梳理了从传统肿瘤相关抗原(TAAs)到个体化新抗原(Neoantigens)的靶点演化,并比较了DNA、RNA、肽段、细胞和病毒载体等多种疫苗平台的优势与挑战。综述特别强调了在辅助治疗(Adjuvant Setting)和转移性(Metastatic)等不同疾病背景下应用疫苗的临床证据差异,指出了当前面临的靶点筛选、个性化生产周期及肿瘤免疫微环境(Tumor Microenvironment, TME)抑制等关键问题,为未来肺癌疫苗的理性设计与临床转化指明了方向。
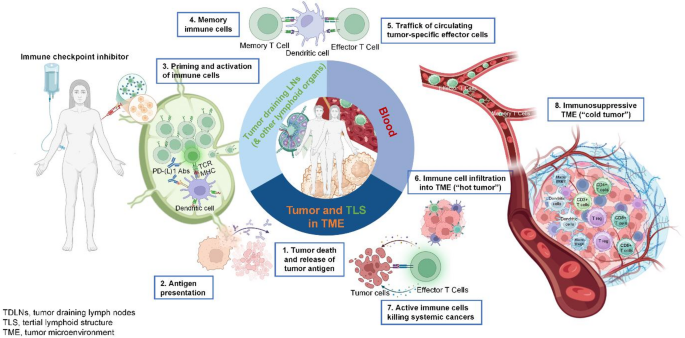
在过去的十年里,免疫检查点抑制剂(ICIs)彻底改变了肺癌的治疗格局,显著提升了抗肿瘤反应、总体生存率和生活质量。然而,持久的临床获益仅在一小部分患者中实现,对ICIs的耐药性仍是重大的临床挑战。其耐药机制复杂多样,包括肿瘤抗原呈递不足、T细胞启动和扩增功能障碍,以及肿瘤微环境(TME)中限制免疫细胞浸润和效应功能的各种物理和免疫抑制屏障。癌症疫苗作为一种理性的免疫治疗策略,通过诱导de novo(新生)或扩增已有的肿瘤特异性免疫反应,从而增强长期免疫记忆,同时保持良好安全性,正在被重新重视以克服这些障碍。抗原发现、新抗原预测和疫苗平台的进步,加速了个体化(Personalized)和“现货型”(Off-the-shelf)新抗原疫苗的发展。尽管基于mRNA的COVID-19疫苗成功后,个体化新抗原疫苗获得了相当多的关注,但“现货型”方法在可扩展性、成本和生产时间上具有优势,便于更广泛的临床实施。越来越多的临床前和临床证据表明,癌症疫苗在辅助治疗背景下比在转移性背景下更有效,因为在转移性背景下,高肿瘤负荷和免疫抑制性的肿瘤微环境限制了疫苗诱导的免疫反应。与它们作为单药疗效有限的特点一致,当代的临床试验越来越多地将癌症疫苗与ICIs或其他免疫治疗剂联合评估,以增强T细胞活化、逆转免疫抑制并恢复抗肿瘤免疫力。
癌症疫苗通过训练免疫系统来识别和攻击肿瘤细胞。抗原表位与佐剂结合,通过特定途径注射。树突状细胞(DCs)吞噬抗原,并在淋巴组织中通过HLA-I和HLA-II分子将其呈递给CD8+细胞毒性T细胞和CD4+辅助T细胞。CD4+T细胞促进CD8+T细胞和B细胞成熟,而B细胞产生抗体,通过自然杀伤(NK)细胞介导体依赖的细胞毒性(ADCC),释放更多的肿瘤抗原。加强免疫可以扩大记忆T细胞和B细胞反应,维持免疫应答。这种协同激活增强了抗肿瘤免疫力,并可被ICIs进一步强化。其核心机制在于将免疫学上的“冷”肿瘤转变为“热”肿瘤,恢复有效的抗肿瘤免疫。
目前的疫苗平台多样,主要可分为DNA、RNA、肽段、细胞基、病毒载体疫苗以及个体化mRNA疫苗。肿瘤细胞疫苗可来源于自体或同种异体肿瘤细胞,其优势在于能同时呈递多种抗原,且诱导的免疫反应不受HLA限制。肽段疫苗是最常用的策略,但其主要局限性是免疫原性低和免疫反应持续时间短。DNA疫苗由编码肿瘤相关抗原(TAAs)和其他免疫调节分子的质粒组成,可实现稳定表达和持续的抗原产生,但存在转入的DNA整合到宿主基因组中的潜在风险。mRNA疫苗是一种新兴的有前景的方法,它们通过in vitro转录合成,在宿主细胞胞质中表达蛋白以引发免疫反应,具有成本效益且无基因组整合风险,但存在不稳定性及体内递送效率低的问题。基因改造的溶瘤病毒疫苗被设计为选择性地在肿瘤细胞内复制并消灭肿瘤细胞,这些病毒可促进自体肿瘤抗原的释放,并可进一步修饰以递送mRNA/DNA构建体或展示新抗原肽段的病毒样颗粒(VLPs)。病毒载体疫苗的一个主要优势是其强大的免疫原性。
肺癌的疫苗靶点主要分为已知的非致癌基因靶点(传统靶点)和新兴的致癌靶点。传统靶点包括在癌细胞上相对于正常细胞高表达、且相对局限于肿瘤细胞的肿瘤相关抗原(TAAs),以及由癌症细胞独有的遗传或表观遗传改变产生的肿瘤特异性抗原(TSAs)或癌症新抗原。被研究过的TAAs包括粘蛋白1(MUC1)、黑色素瘤相关抗原(MAGE)、NY-ESO-1和癌胚抗原(CEA)等。新兴的致癌靶点则是那些驱动肺癌发生、发展的基因突变产物,其中KRAS是NSCLC中最常突变的致癌基因,约20-25%的病例中存在,是目前癌症疫苗研究最广泛的靶点。针对KRAS、ALK、EGFR等致癌突变的“现货型”疫苗正在开发中,旨在为携带这些突变的广大患者群体提供治疗选择。值得注意的是,一项联合疫苗方案,包含黑猩猩腺病毒(ChAd68)和自我扩增mRNA(samRNA),靶向多种RAS和CTNNB突变,与ICIs联合用于转移性实体瘤的研究正在进行。
与“现货型”疫苗不同,个体化癌症疫苗旨在靶向患者特异的新抗原。这种方法基于新抗原由肿瘤特异性遗传改变产生,而高度多态性的HLA分子决定了哪些新抗原衍生肽能被每位患者的T细胞有效呈递和识别。因此,免疫原性新抗原组在很大程度上是患者特异性的,这为旨在选择性靶向肿瘤限制性突变的个体化疫苗策略提供了生物学依据。在NSCLC中,肿瘤突变负荷(TMB)因患者、吸烟、致癌基因突变状态等因素差异很大。高TMB(≥ 10突变/Mb)的肿瘤会产生更多的新抗原,从而增加了用于个体化癌症疫苗开发的候选靶点库。个体化疫苗的递送平台与“现货型”类似,包括基于肽、核酸、细胞或工程病毒载体的形式。但其制造过程更复杂,通常从样本采集到疫苗给药的周转时间约为3-4个月,这对疾病快速进展的患者构成了重大挑战。尽管如此,多项临床试验已展示了个体化疫苗(如mRNA-4157、NEO-PV-01、VB10.NEO等)的安全性和诱导特异性T细胞免疫反应的能力。
此外,粘膜疫苗作为一种有前景的给药途径受到关注。呼吸道的粘膜免疫系统是抵御病原体的前线防线。研究表明,粘膜(鼻内)疫苗接种在控制头颈部肿瘤、原发性肺肿瘤和乳腺癌肺转移方面优于全身性肌肉注射疫苗接种。其核心机制在于在呼吸道和肺实质内强烈诱导组织驻留记忆T细胞(TRM),这可以成为疫苗反应的关键决定因素。临床前研究也显示,鼻内递送的癌症疫苗可以预防自发性KRAS突变肺癌小鼠模型的肿瘤发生。
为了提高疫苗效力,佐剂的使用至关重要。许多实验室生产的癌症疫苗,特别是基于肽和亚单位的疫苗,自身缺乏足够的内在先天免疫激活能力。为了引发强烈的免疫反应,通常需要将小肽段或非蛋白抗原与较大的载体蛋白化学偶联,并与佐剂共同给药。佐剂通过多种机制增强疫苗免疫原性,包括增加抗原可用性、激活先天免疫途径、促进抗原呈递细胞(APCs)的募集和成熟。免疫刺激佐剂如粒细胞-巨噬细胞集落刺激因子(GM-CSF)可直接增强免疫激活。靶向Toll样受体(TLRs)的佐剂也特别有前景,例如聚肌胞苷酸(poly(I:C))和聚肌胞苷酸-赖氨酸羧甲基纤维素(poly-ICLC)是合成的双链RNA分子,可结合内体TLR3,模拟病毒感染并诱导I型干扰素和促炎细胞因子产生。
尽管前景广阔,肺癌疫苗仍面临诸多挑战与机遇。首先,选择最佳疾病背景至关重要。在肺癌领域之外,癌症疫苗在辅助治疗背景下(即在确定性手术或其他治愈性治疗后给药)通常比在转移性背景下更有效。支持这一模式的生物学和免疫学原理包括:辅助治疗时肿瘤负荷低(微小残留病,MRD)、免疫抑制性肿瘤微环境较少、T细胞耗竭程度轻、可与增强抗原释放的治疗(如手术、放疗)联合、以及早期肿瘤基因组突变和免疫逃逸机制较少。临床经验也表明,ICIs在早期和围手术期NSCLC中的获益始终大于转移性疾病。因此,辅助治疗背景为癌症疫苗提供了独特的有利免疫窗口。在转移性背景下,癌症疫苗单独应用的临床抗肿瘤效果有限,通常需要与有效的治疗方法联合使用,以控制癌症所需快速、强大和有效的抗肿瘤效果。
其次,致癌基因驱动的NSCLC对免疫治疗存在机制性限制。ICI疗法在致癌基因驱动的NSCLC中疗效有限,尤其是在EGFR突变肿瘤中未观察到显著的生存获益。大多数致癌基因驱动的NSCLC(除了KRAS突变和BRAF V600E突变亚型)往往具有低TMB,导致免疫原性降低。因此,小分子酪氨酸激酶抑制剂(TKIs)仍是EGFR突变和ALK重排NSCLC的一线标准治疗。然而,对TKIs的耐药几乎不可避免。临床前研究表明,ALK驱动的NSCLC对ICIs反应不佳可能是由于针对ALK抗原的CD8+T细胞启动不足,而靶向疫苗接种策略有可能通过恢复肿瘤免疫原性来克服这一限制。但个体化疫苗在致癌基因驱动的NSCLC中的可行性仍不确定,低TMB与疫苗疗效差和重大制造挑战相关。
第三,有效的新抗原选择存在机制性决定因素。癌症疫苗有限的临床成功部分归因于次优的新抗原选择策略。有效的新抗原选择需遵循几个关键原则:克隆性、与自身的区分度、抗原性、基因组稳定性和广泛的HLA结合能力。此外,一些TAAs含有与正常组织中表达的其他人类蛋白共享的表位,这可能增加脱靶T细胞反应性的风险,从而损害疫苗的安全性和有效性。准确识别既能被MHC分子呈递又能诱导免疫反应的新抗原仍然是一个重大挑战。这个过程不仅取决于肽-MHC结合亲和力,还取决于后续结合肽的免疫原性。最常用的方法是利用计算机in silico预测数千种肽与有限MHC I类等位基因子集之间的结合亲和力。然而,这些方法往往过度简化了抗原呈递的复杂性。体内研究表明,只有不到6%的预测新抗原能引发功能性T细胞反应,即使是预测亲和力低的肽也可能具有免疫原性。替代策略包括直接从原发肿瘤组织中鉴定MHC分子呈递的突变肽,但该技术灵敏度有限。另一种方法是分离已引发T细胞反应的新抗原,但这仅限于已存在的免疫反应性。
展望未来,肺癌疫苗的发展需要跨学科合作,整合基因组学、免疫学、生物信息学和材料科学的最新成果。优化新抗原预测算法、开发高效安全的递送系统、探索最佳的联合治疗策略(如与ICIs、靶向治疗、化疗或放疗联用)、以及确定最有可能受益的患者群体,是推动该领域前进的关键。随着更多临床试验数据的积累和技术的不断革新,癌症疫苗有望在肺癌的综合治疗中扮演越来越重要的角色,为实现更精准、更持久的肿瘤控制带来新的希望。