编辑推荐:
本文作者主要讨论慢性炎症免疫和代谢的影响肝脏微环境,并举例说明免疫和代谢的影响微环境对原发性肝癌的发展以及它如何影响肝癌的迁移。
肝癌是全球第四大癌症致死原因。炎症是诱发原发性肝癌的主要因素,慢性炎症主要由HBV感染、HCV感染、代谢异常(酒精性脂肪肝、NASH)和长期接触有毒物质引起。
在本文中,作者主要讨论慢性炎症免疫和代谢的影响肝脏微环境,并举例说明免疫和代谢的影响微环境对原发性肝癌的发展以及它如何影响肝癌的迁移。
要成功地治疗原发性肝癌,首先必须了解其发生的原因。慢性炎症是诱发原发性肝癌的主要因素。
慢性肝炎的发生与以下刺激和变化有关:例如,病毒感染引起免疫细胞活化;慢性肝损伤释放促炎因子,引起先天免疫细胞激活;外源性毒素、脂肪酸介导的脂肪毒性和过量的铁沉积导致肝细胞类型的改变,包括肝细胞和肝窦内皮细胞(LSECs)。
肝脏作为机体代谢的主要器官,不断受到肠道病原体、微生物相关分子、toll样受体(TLR4和TLR9)激动剂及各种代谢物的攻击。因此,肝脏具有免疫抑制极性,能够减弱T细胞介导的抗原反应,这种免疫抑制是由其他驻留的细胞群维持的,包括KCs、树突状细胞(DCs)、调控性T细胞(Treg)和LSECs(图1)。
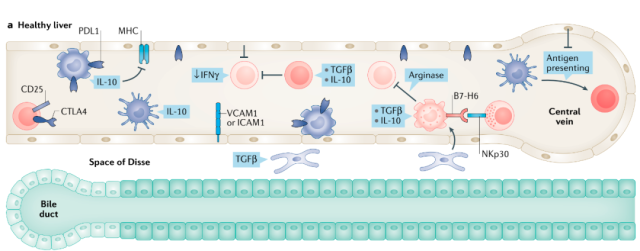
图1在健康肝脏中,肝脏驻留细胞和外周白细胞或骨髓细胞产生并维持免疫抑制能力
KCs是最大的组织驻留巨噬细胞群体,介导肝脏免疫抑制(PDL1)和低水平的共刺激分子(CD80和CD86)。
HSCs通过产生转化生长因子β (TGF-β)等抗炎因子促进肝脏免疫抑制,从而激活组织再生途径,刺激炎症单核细胞分化为骨髓源性抑制细胞(MDSCs)。
在小鼠肝脏中,有两种NK细胞亚型:常规NK细胞(不表达CD49a但表达DX5)和肝脏特异性NK细胞(表达CD49a但不表达DX5)。特异性NK细胞类似经典记忆细胞,表达高水平的IFNγ。
Treg细胞是T细胞的一个子集,控制自身免疫反应,分泌抗炎因子(如TGFβ和IL-10),并发挥免疫抑制特性。
LSECs表达PDL1、分子识别受体和黏附分子1(如细胞内黏附分子ICAM1)和血管细胞黏附分子(VCAM1),调节淋巴组织通透性和MHC class 1和class 11。
肝细胞死亡是伴随NASH、病毒性肝炎、肝硬化等慢性肝病的过程,包括凋亡、坏死和坏死三种形式。细胞死亡的类型影响原发性肝癌的类型。
由于细胞膜完整性的丧失,死亡的肝细胞释放出大量与损伤相关的分子。这些“内源性抗原”,连同过量的酒精或脂肪酸分解代谢产物和异常的代谢物,破坏了平衡的免疫耐受。
KC首先反应,激活受体识别途径,产生大量促炎因子(如IL-1、IL-6、TNF、CCL1、CCL2和CCL5),上调细胞粘附因子ICAM1和VCAM1的表达水平,下调LSEC上PECAM1招募单核细胞、中性粒细胞和血小板的表达水平。
在激活先天免疫细胞后,适应性免疫细胞和炎症细胞随后被激活(图2)。在NASH小鼠和NASH患者中检测CD4+和CD8+ T细胞的积累。
研究表明,CD4+ T细胞促进IFN-γ分泌,从而促进肝脏炎症;CD8+ T细胞的免疫缺失可促进NASH诱导的肝损伤。
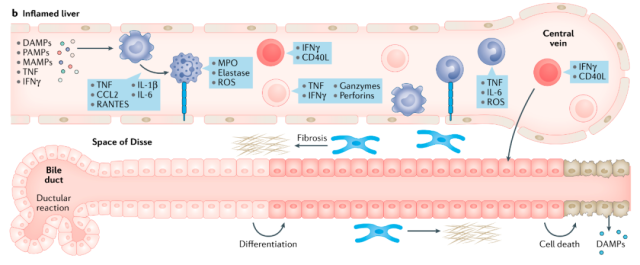
图2。在炎症性肝病的进展过程中,炎症或代谢异常促进肝脏应激部位的先天免疫反应(如Kuppfer细胞、中性粒细胞、树突状细胞(dc)和单核细胞招募的激活)和适应性免疫反应的激活。免疫激活进一步破坏肝细胞稳态,导致肝细胞循环,肝星状细胞激活,肝窦内皮细胞(LSECs)黏附分子表达,进而引发肝炎。
肝脏在维持系统平衡方面起着重要的作用。肝小叶是肝脏结构和功能的基本单位。
各肝小叶中心、肝板、肝血窦、窦周间隙及以中心静脉为中心轴的胆管均有一条中心静脉,共同构成了复杂的肝小叶三维形态(图3)。
血液从门静脉流过肝窦,流入中央静脉,然后流入腔静脉。因此,在肝脏中产生了一个氧梯度:在门静脉中较高,在中央静脉中较低。由于氧梯度的存在,不同区域的肝细胞有不同的功能。
如图3所示,门静脉(1区)氧含量较高,肝细胞在门静脉承担蛋白质合成和分泌、糖异生、脂肪酸β-氧化等消耗ATP较多的任务;中央静脉(3区)周围的氧含量相对较高。低,肝细胞在这里承担低能量消耗的任务,如解毒、脂肪合成和糖蛋白合成。
肝细胞与非实质细胞密切相关,非实质细胞的空间分布特征影响肝细胞的功能和更新。
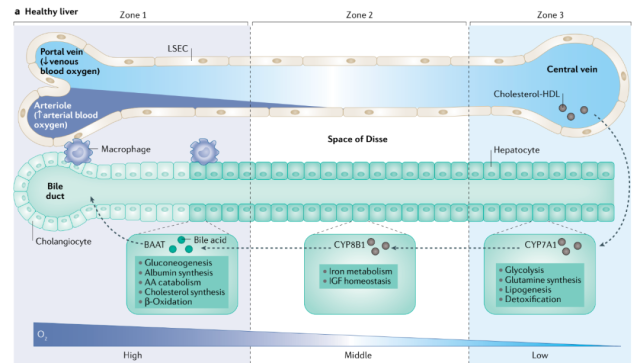
图3。健康肝组织的结构和功能。肝细胞沿空间结构和氧浓度梯度完成代谢、合成和解毒,这些功能按能量需求即氧含量进行划分。
在肝损伤的背景下,肝细胞的空间结构和功能发生改变(图4)。肝脏代谢功能的时空分布创造了实质细胞和非实质细胞相互作用的微环境。肝脏炎症会破坏这种平衡,进而导致癌症。
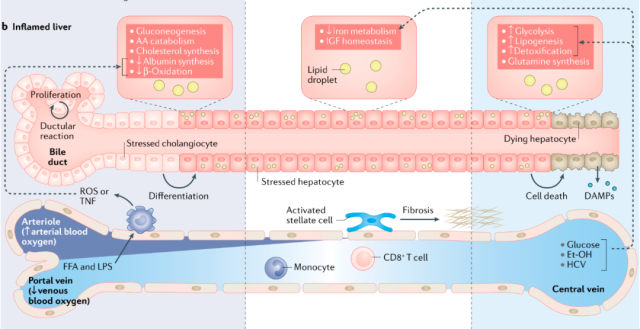
图4肝脏代谢微环境在病理条件下发生特异性变化,并发展为癌症。代谢微环境的破坏激活先天免疫反应,这反过来又维持炎症过程。在慢性坏死性炎症的背景下,这些变化反过来导致肝细胞的代谢适应,导致癌前特征的形成和进行代谢重排。箭头表示代谢产物及其中间体在肝小叶不同区域的运输。
许多体内实验表明,慢性肝炎可诱发癌症。KCs细胞分泌的促炎因子TNF在氧化应激下激活JNK信号通路和WNT-β-catenin蛋白信号通路,从而引起癌变。淋巴毒素β、TNFSF14及其靶基因CCL17和CCL20在小鼠和人肝癌中过表达,表明淋巴毒素可以激活NF-κB通路。炎症因子IL-6、IL-1β、IL-11、IL-23等也与肝癌的发生有关。
其中,IL-6与二乙基亚硝胺引起的肝癌相关性最高,即病毒性肝炎向HCC的过渡。标记。
此外,在炎症环境中,丰富的血管生成素、血管内皮生长因子(VEGFs)、CXC趋化因子配体1 (CXCL1)和CXCL8可以刺激血管生成,这是肝脏肿瘤发生的必要过程。
炎症诱导的细胞死亡和增殖导致氧化应激,进而导致肝细胞DNA损伤和基因突变。8- Oxo -7,8-二氢-20-脱氧鸟嘌呤和8-硝基鸟嘌呤,诱导ROS和活性氮积累,抑制DNA修复机制中的关键酶,进一步提高突变率。
在氧化应激的背景下,细胞癌基因的激活和细胞融合诱导肝细胞衰老。如果不能有效地消除遗传和免疫监控系统,这些衰老细胞就有致癌的可能。
在不同类型的肝脏肿瘤中可以观察到糖、脂质和核苷酸代谢的改变。
肿瘤细胞喜欢糖酵解(它燃烧葡萄糖的效率是有氧呼吸的15倍),以满足过度增殖所需的能量和合成代谢需求。
糖和核苷酸代谢在其他综述中也有阐述,因此,这里主要关注脂质代谢的变化。
在NASH和ash诱导的肝癌中,代谢重排机制至关重要,代谢底物的改变一方面可以促进肝细胞增殖,另一方面可以改变免疫活性。
代谢重排机制包括外周脂肪组织的脂质摄取失衡和脂肪酸动员,导致脂肪酸和葡萄糖的高水平,最终诱导癌细胞适应葡萄糖和脂质分解代谢作为主要能量来源。
这种新陈代谢的重新排列不仅使肝癌细胞有很强的增殖和扩散能力,而且使它们容易产生对化疗药物的耐药性。
代谢环境可以改变肝脏内的免疫应答,使肿瘤细胞发生免疫逃逸(图5)。此外,免疫细胞的代谢重排会导致自身功能异常。
HCC微环境中的巨噬细胞发生M2极化,这一表型与脂肪酸氧化能力增强和肿瘤细胞迁移有关。
代谢重排也会影响T细胞的抗肿瘤活性,在HCC微环境中,Treg细胞的增殖与它们利用含能底物(如脂质和葡萄糖)的能力有关。在肿瘤微环境中,促炎免疫细胞的需氧糖酵解率增加。
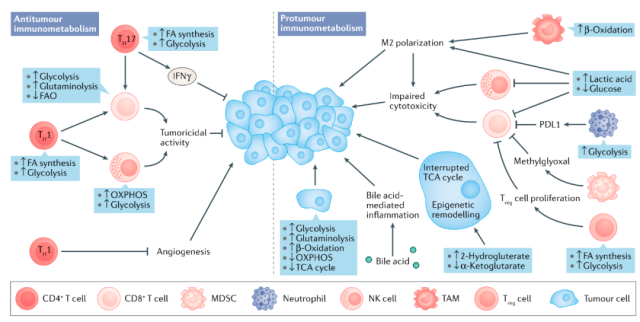
在肝癌中,代谢重排通过支持癌细胞的能量需求和肿瘤免疫微环境在疾病进展中发挥了中心作用。肿瘤细胞上调糖酵解、糖异生和β-氧化以支持快速增殖,导致葡萄糖缺乏和乳酸丰富的微环境。
特定致癌基因的激活或肿瘤抑制基因的突变可诱导细胞内(遗传)或细胞外(免疫细胞介导)的监测程序。
由致癌基因和压力引起的癌细胞可以通过由基因监督的细胞凋亡来清除。
基因监测的主要途径是p53系统对DNA损伤的识别。野生型p53蛋白与受损DNA结合,阻止肝细胞生长,直到DNA损伤修复完成。
CD44诱导MDM2磷酸化,抑制p53的调控功能,从而加速HCC的发展。
基因监测失败后,免疫细胞介导的调节开始发挥作用(图6)。
免疫介导的癌前细胞清除的关键特征包括t细胞免疫应答,这取决于肿瘤相关抗原(如PPIB、SART2、SART3、p53、ABCC3、AFP、GPC3和hTERT124)和相关信号分子的呈现。
NK细胞和自然杀伤T细胞是另一种免疫监视机制。肝癌患者外周血和瘤内组织中肿瘤浸润NK细胞数量减少,细胞因子产生和细胞毒性功能受损。自然杀伤T细胞产生IFN-γ并激活NK细胞,抑制肿瘤生长。
炎症相关的巨噬细胞和单核细胞具有抗肿瘤作用。在肿瘤微环境中,这些细胞被称为肿瘤相关巨噬细胞,具有免疫抑制表型,促进肿瘤进展和转移,如血管生成和伤口修复
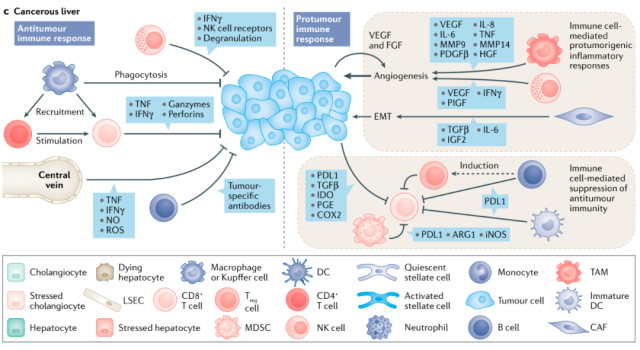
图6肝癌组织LSECs分泌IFN-γ、一氧化氮(NO)和活性氧(ROS)杀死肿瘤细胞;Kuppfer细胞通过吞噬和招募T细胞产生抗肿瘤免疫反应;自然杀伤细胞(NK)也参与抗肿瘤免疫反应。
尽管我们对肝癌的起源和分子特征的认识取得了巨大的进步,但仍然很少有治疗方案可以显著提高患者的生存期和生活质量。
最近,PDL1抑制剂atezolizumab被批准与抗VEGFs药物贝伐单抗(一种治疗晚期肝癌的新标准)联合使用。
最新数据表明,这种联合免疫疗法可以有效监测病毒诱导肝癌的免疫反应。
相反,非病毒型肝癌限制了免疫治疗触发的免疫监测的效果。
因此,靶向治疗和重塑肝脏炎症和代谢微环境,以及更好地了解和精确靶向血管生成、纤维化和营养供应,可以增强肿瘤淋巴细胞浸润,重新建立有效的免疫监测和免疫检查点点击阻断反应。
https://www.nature.com/articles/s41568-021-00383-9
 生物通微信公众号
生物通微信公众号
生物通 版权所有