编辑推荐:
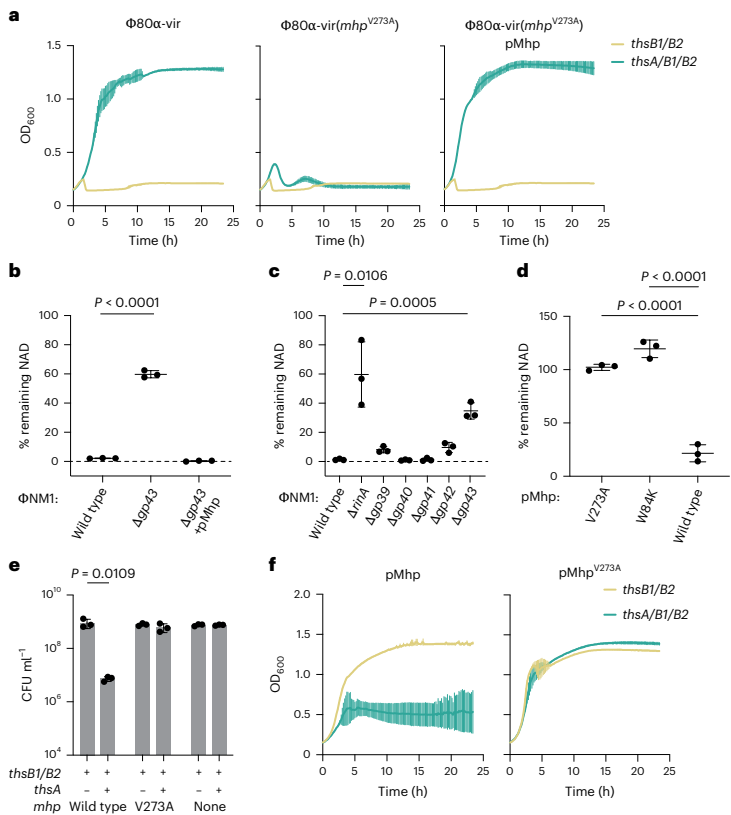
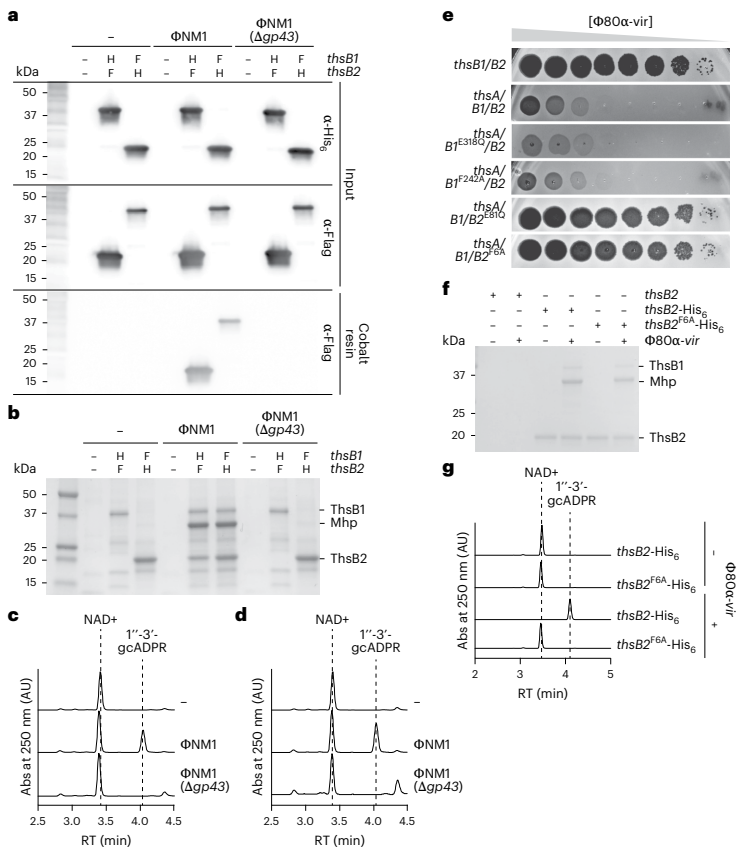
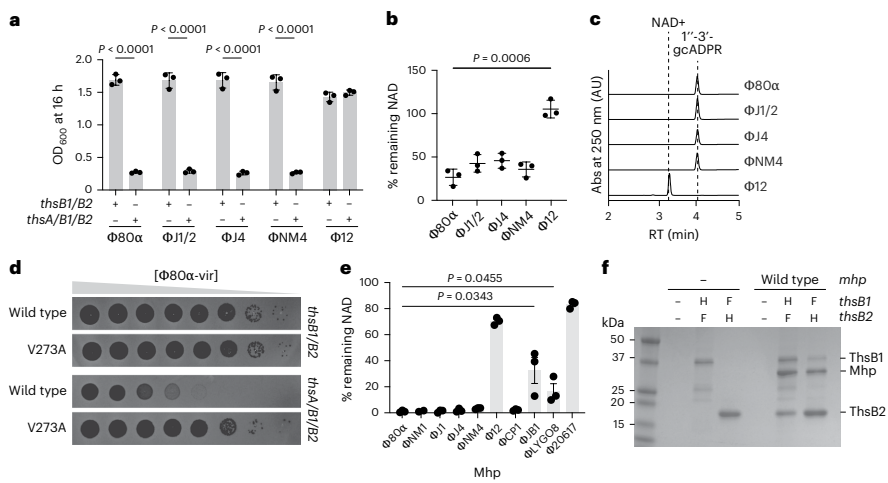
本研究揭示了Thoeris系统通过识别噬菌体主要衣壳蛋白(Mhp)激活细菌免疫的新机制。研究人员发现金黄色葡萄球菌ThsB1/ThsB2传感器与Mhp形成三元复合物,催化生成1"-3'-gcADPR信号分子,进而激活ThsA效应蛋白降解NAD+限制病毒增殖。该发现不仅阐明了原核生物TIR结构域识别病毒结构的保守机制,还为理解病毒衣壳结构多样性进化提供了新视角。

 生物通微信公众号
生物通微信公众号
生物通 版权所有