编辑推荐:
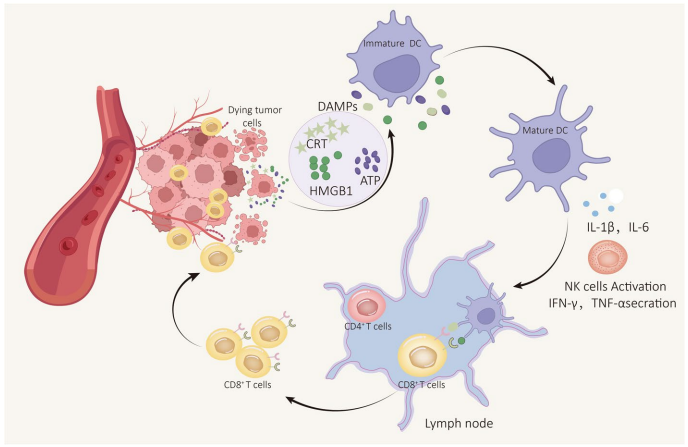
本综述系统探讨了细胞死亡(RCD)与免疫激活之间的相互作用,重点聚焦于免疫原性细胞死亡(ICD)通过释放损伤相关分子模式(DAMPs)重塑肿瘤免疫微环境(TIME)的机制。文章深入分析了不同RCD模式(如凋亡、坏死性凋亡、焦亡、铁死亡、铜死亡等)对免疫细胞浸润、活化和功能的双重影响,并总结了利用化疗、放疗、溶瘤病毒、肿瘤疫苗和纳米技术等诱导ICD的新型治疗策略,旨在为克服肿瘤免疫治疗耐药性提供新见解。



 生物通微信公众号
生物通微信公众号
生物通 版权所有