编辑推荐:
本研究针对帕金森病(PD)异质性难题,通过分析2030例临床和前驱期患者的12年纵向数据,首次系统验证了"体优先"(body-first)和"脑优先"(brain-first)两种病理传播模式的存在。研究结合临床评估、功能磁共振(fMRI)、多巴胺转运体成像(DaTSCAN)和全基因组关联分析(GWAS),发现体优先亚型表现为更严重的运动障碍、焦虑抑郁症状及对称性蓝斑核(LC)尾侧连接异常,而脑优先亚型呈现不对称纹状体多巴胺缺失。鉴定出TRIM40、IP6K2等5个与亚型相关的SNP位点。该研究为PD精准分型治疗提供了重要依据,成果发表于《Molecular Neurodegeneration》。
帕金森病作为第二大神经退行性疾病,长期以来被视作单一疾病进行治疗。然而临床观察发现,患者可能先出现便秘、REM睡眠行为障碍(RBD)等外周症状,或以单侧震颤等中枢症状首发。这种异质性让研究者猜测:是否存在不同起源的病理亚型?丹麦学者Borghammer提出的"突触核蛋白起源与连接组"(SOC)模型假设,α-突触核蛋白(α-synuclein)可能从肠道神经系统(体优先)或大脑(脑优先)开始聚集,但缺乏纵向证据支持。
为解决这一关键问题,由瑞典卡罗林斯卡学院Massimiliano Passaretti领衔的国际团队,利用帕金森病进展标志物倡议(PPMI)队列的12年随访数据,对1120例临床患者和910例前驱期个体展开多模态研究。通过整合临床量表、神经影像和遗传学分析,首次证实两种亚型在前驱期就已显现特征差异,且具有独特的病理传播模式和遗传基础。这项开创性研究为理解PD异质性提供了全新框架,相关成果发表于《Molecular Neurodegeneration》。
研究采用四项关键技术:1)基于RBD问卷(RBDSQ)和自主神经功能量表(SCOPA-AUT)的亚型分类;2)功能磁共振(fMRI)分析蓝斑核(LC)功能连接梯度;3)单光子发射计算机断层扫描(SPECT)量化纹状体多巴胺转运体(DaT)结合率;4)全基因组关联分析(GWAS)筛选表型相关单核苷酸多态性(SNP)。所有数据来自国际多中心PPMI队列,经过统一采集和质量控制。
基线特征揭示亚型差异
临床和前驱期体优先组均表现出更严重的运动障碍(UPDRS III评分更高,β=0.13-0.45)和情绪症状。特别值得注意的是,体优先前驱期患者已出现显著震颤(β=0.1)和上肢症状(β=0.13),打破了传统认为震颤是"良性"症状的认知。
纵向进展凸显亚型特异性
体优先组呈现更快进展:年运动功能恶化率(UPDRS III β*time=0.02)、注意力下降(符号数字模态测试SDMT β*time=-0.78)更显著。更惊人的是,体优先前驱期患者转化为临床PD的风险是脑优先组的2.02倍(HR 95%CI:1.15-3.55)。
影像学验证病理传播模式
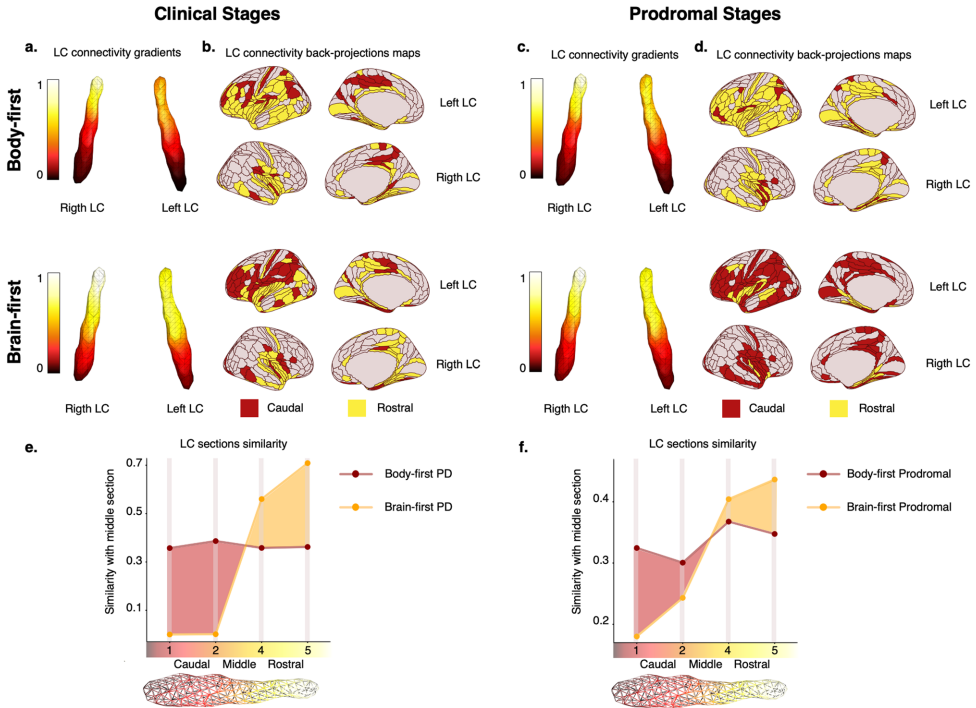
遗传分析发现风险位点
GWAS鉴定出TRIM40(rs9261484-T)等2个脑优先风险等位基因,以及IP6K2(rs12497850-G)等3个保护性位点。前驱期追踪显示,TRIM40杂合子(C/T)携带者运动恶化更快(β*time=0.15),而RIT2纯合子(G/G)进展较慢,为早期干预提供分子靶点。
无监督学习验证分类可靠性
变分自编码器(VAE)分析将11维特征压缩至2维潜在空间,成功区分两种亚型(p<0.001),且错误分类率(5年6.7%)显著低于传统运动/认知分型(最高24.4%)。
这项研究通过多维度证据链,确立了体优先/脑优先分类的生物学基础。体优先亚型表现为自下而上、对称性病理传播,与更快进展相关;脑优先亚型则呈现自上而下的不对称模式。临床意义在于:1)前驱期量表组合可预测转化风险;2)LC连接模式和DTI-ALPS指数可作为影像标志物;3)TRIM40等基因变异指导个体化预后评估。
研究也存在一定局限:RBDSQ依赖主观报告,未使用心肌MIBG闪烁扫描等客观指标;前驱期队列未完全覆盖PD风险谱。未来研究可结合α-突触核蛋白种子扩增试验(αS-SAA)和肠道微生物组分析,进一步阐明病理起源机制。该成果为PD精准医学实践奠定基础,推动针对不同亚型的疾病修饰疗法开发。
 生物通微信公众号
生物通微信公众号
生物通 版权所有