编辑推荐:
本研究针对PD-1/L1抑制剂单药治疗响应率有限的临床困境,创新性地开展双靶点mTORC1/2抑制剂onatasertib联合PD-1抗体toripalimab的I/II期临床试验(TORCH-2)。研究证实该联合方案安全性可控,在宫颈癌患者中实现52.4%的客观缓解率(ORR)和5.8个月中位无进展生存期(PFS),且疗效与PD-L1表达无关,为免疫治疗耐药患者提供了新策略。
研究背景与科学问题
免疫检查点抑制剂(CPI)虽革新了肿瘤治疗格局,但PD-1/PD-L1抗体单药治疗仅能使部分患者获益。在宫颈癌领域,即使PD-L1阳性患者接受pembrolizumab治疗的客观缓解率(ORR)不足20%,而PD-L1阴性患者几乎无响应。与此同时,PI3K-AKT-mTOR通路的异常激活在多种肿瘤中被证实可促进免疫逃逸,临床前研究显示mTOR抑制剂能通过调节肿瘤微环境(TME)增强PD-1抗体疗效,但缺乏临床证据支持。
为解决这一转化医学难题,由四川大学华西医院领衔的研究团队开展了全球首个mTORC1/2双靶点抑制剂onatasertib(CC-223)联合PD-1抗体toripalimab的I/II期临床试验(TORCH-2/NCT04337463),成果发表于《Signal Transduction and Targeted Therapy》。
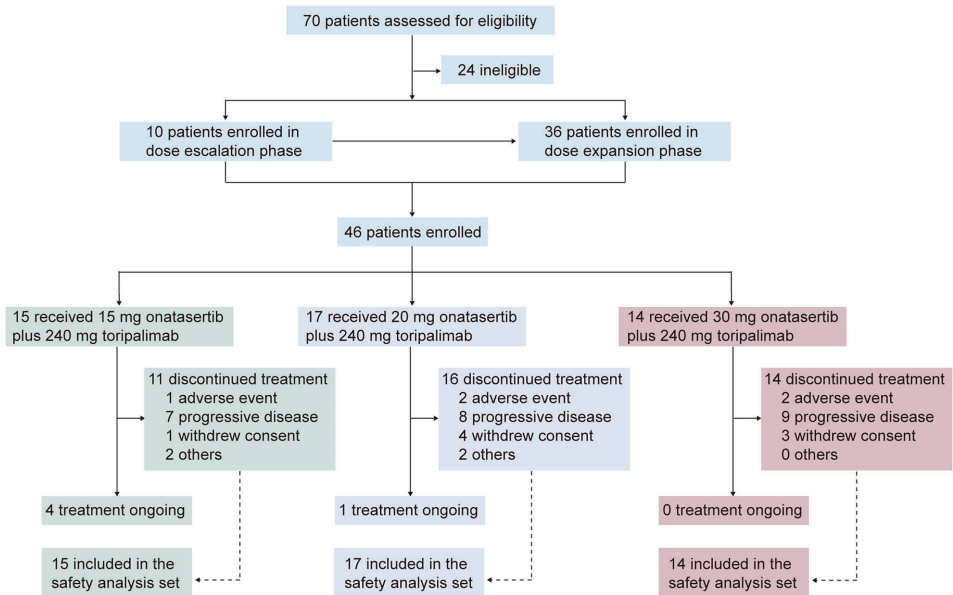
关键技术方法
采用多中心、开放标签的"3+3"剂量递增联合扩展设计,纳入46例晚期实体瘤患者(45.7%为宫颈癌)。给药方案为onatasertib(15/20/30 mg QD)口服联合toripalimab(240 mg Q3W)静脉注射,主要评估安全性(CTCAE v5.0)、药代动力学(PK)和疗效(RECIST 1.1)。通过免疫组化检测PD-L1表达(TPS≥1%为阳性),采用Kaplan-Meier法分析生存数据。
研究结果
安全性结果
未观察到剂量限制性毒性(DLT),最常见3-4级治疗相关不良事件(TEAE)为淋巴细胞减少(23.9%)和皮疹(19.6%)。30 mg组因毒性导致的剂量调整更频繁,15 mg组平均治疗持续时间最长(43.6周)。
药代动力学特征
10例患者的PK分析显示,toripalimab联合给药未显著改变onatasertib的血浆浓度-时间曲线,提示无临床意义的药物相互作用。
疗效数据
全人群ORR达26.1%,疾病控制率(DCR)73.9%,中位PFS 4.3个月。宫颈癌亚组表现突出:

PD-L1表达相关性
PD-L1阳性与阴性患者的中位PFS无显著差异(5.5 vs 4.3个月),突破现有免疫治疗依赖PD-L1筛选的局限。
结论与意义
该研究首次临床验证mTORC1/2抑制剂联合PD-1抗体的协同效应,确立15 mg onatasertib QD联合240 mg toripalimab Q3W为推荐II期剂量(RP2D)。其重要意义在于:
未来需在更大样本中验证该方案对宫颈癌及其他PI3K-AKT-mTOR通路异常肿瘤的疗效,并探索TILs浸润等预测性生物标志物。该研究为免疫联合靶向治疗提供了新范式,尤其对解决免疫治疗耐药问题具有重要临床价值。

 生物通微信公众号
生物通微信公众号
生物通 版权所有