编辑推荐:
本研究针对30-40%弥漫大B细胞淋巴瘤(DLBCL)患者对一线免疫化疗无持久响应这一临床难题,通过整合多组学分析228例复发/难治性DLBCL(rrDLBCL)样本,结合444例初诊DLBCL(ndDLBCL)数据,揭示了GCB和DZsig+亚型特有的MYC/BCL2/BCL6/TP53等驱动基因变异模式。研究发现治疗耐药克隆在诊断时即存在,且复发肿瘤呈现微环境活性降低的克隆扩张特征,为高危患者分层和个体化治疗提供了分子框架。
在血液肿瘤领域,弥漫大B细胞淋巴瘤(DLBCL)是最常见的非霍奇金淋巴瘤亚型,约占所有病例的30%。虽然R-CHOP等免疫化疗方案使超过65%患者获得长期缓解,但仍有30-40%患者面临复发或原发耐药困境,特别是早期进展患者中位生存期不足5个月。这种临床异质性背后,隐藏着怎样的分子奥秘?为何标准治疗方案在某些患者中失效?这些问题的解答对改善高危患者预后至关重要。
Mayo Clinic的研究团队在《Blood Cancer Journal》发表了一项里程碑式研究。通过整合基因组学与转录组学分析,团队系统描绘了228例复发/难治性DLBCL的分子特征,并与444例初诊病例进行对比。研究采用全外显子测序(WES)/全基因组测序(WGS)检测体细胞突变和拷贝数变异(CNV),RNA测序进行细胞起源(COO)分型和微环境分析,TRUST4算法重建B细胞受体(BCR)谱系,结合临床随访数据揭示治疗耐药机制。
研究纳入Mayo Clinic/University of Iowa等中心的228例rrDLBCL和444例ndDLBCL样本。DNA测序平均覆盖度78.4x(WES)和38.2x(WGS),检测292个淋巴瘤相关基因和45个基因组区域。RNA测序采用Reddy方法进行COO分型,引入DZsig+精分亚型。通过PyClone-VI和ClonEvol分析克隆进化,CIBERSORTx评估微环境组成。
rrDLBCL呈现特征性变异模式:高频突变涉及KMT2D(27%)、TP53(22%)、CREBBP(18%)等表观调控基因;拷贝数扩增集中在18q21.33(BCL2,31%)和8q24.21(MYC,25%),缺失多见于17p13.1(TP53,23%)。与原发肿瘤相比,rrDLBCL显著富集MS4A1(CD20,3.4% vs 0.5%)和STAT6(7.8% vs 3.7%)突变,提示抗CD20治疗耐药和微环境重塑机制。
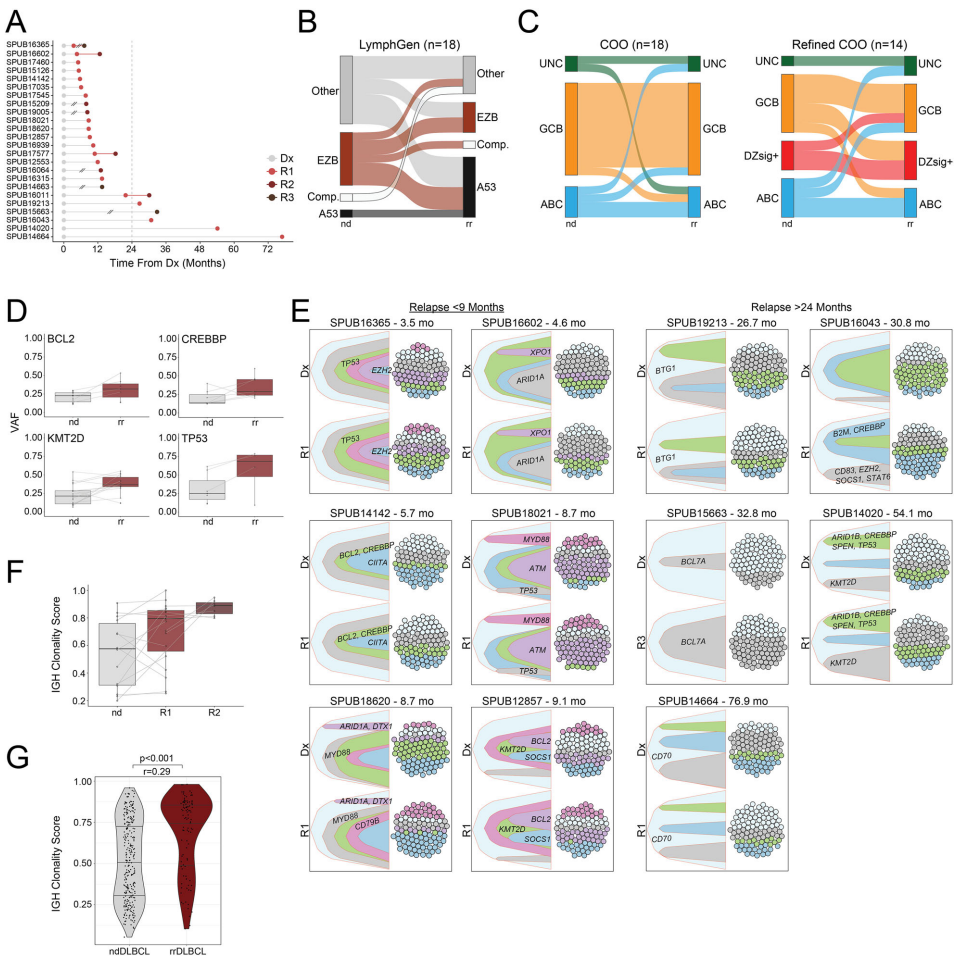
精分COO显示DZsig+亚型在rrDLBCL中占16.4%,其患者中位生存仅15个月。该亚型特有BCL6/SPEN/ARID1A突变(频率>25%),伴随CD20表达下调。GCB亚型rrDLBCL则富集CIITA/EP300/SOCS1变异和8q24.21(MYC)扩增。值得注意的是,DZsig+和GCB亚型在原发耐药患者中占比达61%,显著高于ABC亚型(23%)。
24例配对分析显示,73%的复发克隆在诊断时即存在,呈现线性进化模式。BCR谱系分析显示复发肿瘤克隆性评分显著升高(p<0.001),证实优势克隆选择过程。原发耐药患者更易携带TP53(35% vs 15%)和EZH2(12% vs 5%)突变,提示表观遗传调控异常在早期耐药中的作用。
rrDLBCL呈现免疫微环境(LME)耗竭特征,CD8+T细胞(p=0.004)和滤泡辅助T细胞(p<0.001)浸润减少。这种免疫抑制状态在DZsig+亚型中尤为显著,可能与其特有的IKZF3突变(27%)相关。
该研究建立了迄今最大规模的rrDLBCL多组学数据库,揭示三个关键发现:(1)治疗耐药克隆在诊断时即存在,GCB和DZsig+亚型具有独特驱动变异谱;(2)原发耐药与TP53/EZH2突变和MYC/BCL2通路异常密切相关;(3)复发肿瘤呈现克隆均质化和微环境耗竭特征。这些发现为临床实践提供重要启示:对初诊DLBCL进行COO精分和靶向测序(如MYC/BCL2/TP53)可前瞻性识别高危患者;DZsig+亚型患者可能从CD19 CAR-T等替代方案获益;针对表观遗传调节剂(EZH2抑制剂)和BCL2抑制剂(venetoclax)的联合策略值得在特定亚型中探索。研究为实现DLBCL精准分层治疗迈出关键一步。
 生物通微信公众号
生物通微信公众号
生物通 版权所有