编辑推荐:
本研究针对肝细胞癌(HCC)代谢重编程与RNA代谢的交叉调控机制,揭示了磷酸甘油酸脱氢酶(PHGDH)作为RNA结合蛋白(RBP)通过识别PRKCD mRNA 3'UTR的AGUGGAA motif,招募IGF2BP3增强mRNA稳定性,激活线粒体自噬(mitophagy)并抑制凋亡的促癌新机制。研究人员开发靶向PHGDH RNA结合域的诱饵寡核苷酸,联合索拉非尼显著抑制HCC进展,为代谢酶-RNA互作网络在肿瘤治疗中的应用提供新策略。
肝细胞癌(HCC)是全球癌症相关死亡的主要原因之一,其治疗面临早期诊断困难、晚期耐药性高等挑战。代谢异常是HCC的显著特征,但代谢酶如何通过非经典功能调控肿瘤进展尚不明确。近期,重庆医科大学的研究团队在《Signal Transduction and Targeted Therapy》发表重要成果,首次揭示丝氨酸合成通路关键酶——磷酸甘油酸脱氢酶(PHGDH)作为RNA结合蛋白(RBP)的全新功能,为HCC治疗提供了创新靶点。
研究团队通过UV交联RNA互作捕获技术,在HCC细胞中筛选出PHGDH等60个代谢相关潜在RNA结合蛋白。利用RNA免疫沉淀测序(RIP-seq)和生物信息学分析,发现PHGDH特异性结合PRKCD mRNA的3'非翻译区(3'UTR)保守基序AGUGGAA,并通过其新鉴定的RNA结合域(RBD,125-166位氨基酸)维持结合活性。机制上,PHGDH通过还原酶结构域(RD)招募mRNA稳定因子IGF2BP3,形成PHGDH-IGF2BP3-PRKCD mRNA三元复合物,显著延长PRKCD mRNA半衰期(从4.5小时增至7.2小时),导致PRKCD蛋白水平升高。
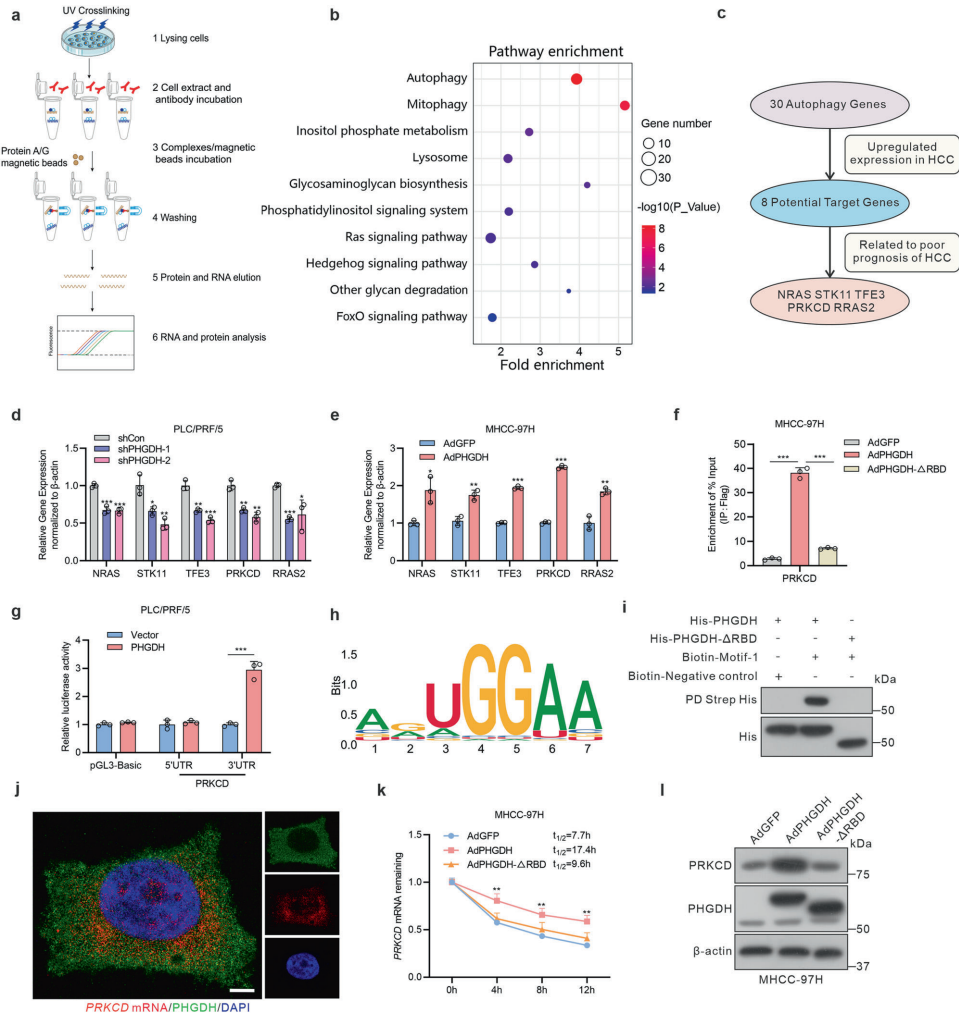
功能实验显示,PHGDH-PRKCD轴通过磷酸化ULK1(Ser555)和Beclin1(Ser15)激活线粒体自噬起始复合体,降低线粒体膜电位(JC-1染色显示红/绿荧光比值下降50%),同时上调抗凋亡蛋白BCL2(2.3倍)并抑制BAX表达(60%)。在DEN/CCl4诱导的小鼠HCC模型和患者来源异种移植(PDX)模型中,PHGDH敲除使肿瘤数量减少65%,并伴随PRKCD水平下降和凋亡增加。
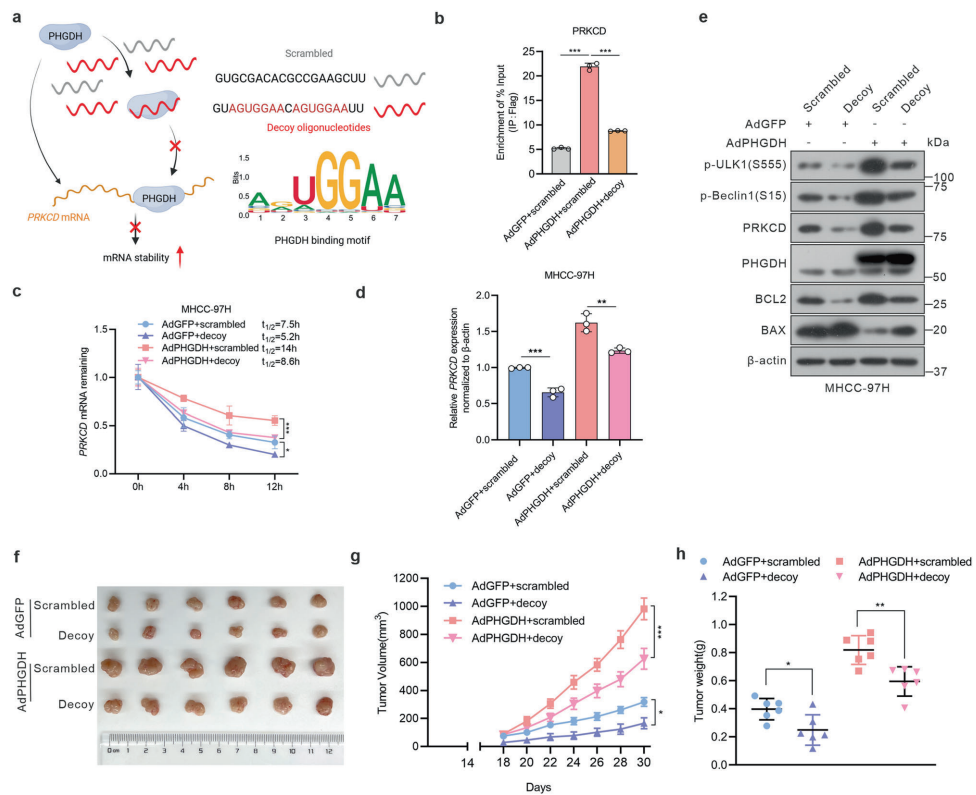
治疗策略上,基于AGUGGAA基序设计的诱饵寡核苷酸可竞争性抑制PHGDH-RNA结合,使PRKCD蛋白水平降低70%。该寡核苷酸与索拉非尼联用,在YAP诱导的HCC小鼠模型中显示协同效应(肿瘤体积缩小82% vs 单药45%)。PRKCD抑制剂sotrastaurin(30 mg/kg)同样表现出显著抑瘤效果。
关键技术包括:1)UV交联RNA互作捕获联合质谱筛选RBP;2)RIP-seq和motif分析鉴定PHGDH结合位点;3)构建PHGDH酶活突变体(V425M)和RBD缺失突变体(ΔRBD);4)DEN/CCl4化学诱导和PDX小鼠模型验证体内功能;5)线粒体膜电位(JC-1)和透射电镜检测线粒体自噬。
这项研究突破性发现:1)PHGDH是首个被证实具有RNA结合活性的丝氨酸代谢酶;2)PHGDH-IGF2BP3-PRKCD轴构成代谢-RNA调控新通路;3)靶向RBP功能的诱饵策略为HCC治疗开辟新途径。临床数据分析显示,PHGDH与PRKCD共高表达患者总生存期缩短40%(TCGA数据,P<0.001),提示该机制具有重要转化价值。研究不仅深化了对代谢酶"兼职"功能的认识,更为联合靶向代谢和RNA调控的精准治疗提供理论依据。
 生物通微信公众号
生物通微信公众号
生物通 版权所有