编辑推荐:
本研究针对青少年重性抑郁障碍(AMDD)的异质性问题,整合形态相似网络(MSN)和空间转录组学技术,成功鉴定出两种神经生物学亚型:AMDD1(前额顶叶网络连接减弱伴冲动性)和AMDD2(边缘视觉环路连接增强伴情绪失调),揭示了亚型特异的分子机制(如AMDD1的突触修剪缺陷和AMDD2的GABA能抑制缺陷)和细胞类型特征(星形胶质细胞失调vs小胶质细胞激活),为青少年抑郁症的精准诊疗提供了新框架。研究发表于《Molecular Psychiatry》。
青少年时期是大脑发育的关键窗口期,也是抑郁症的高发阶段。然而令人困惑的是,具有相同诊断标签的青少年抑郁症患者,对治疗的反应和预后却存在巨大差异。这种临床异质性背后,可能隐藏着不同的神经生物学机制。更棘手的是,当前基于症状的诊断标准无法捕捉这些本质差异,导致近50%的青少年患者对一线抗抑郁药反应不佳。面对这一困境,中国医科大学附属第一医院的研究团队在《Molecular Psychiatry》发表了一项开创性研究,通过整合脑结构网络分析和基因表达图谱,首次揭示了青少年抑郁症的神经生物学亚型及其发育机制。
研究团队采用了多模态研究策略:首先利用结构磁共振成像构建了308个脑区的形态相似网络(MSN),通过HYDRA算法对179例患者进行亚型分类;随后整合艾伦人脑图谱(AHBA)的空间转录组数据,采用偏最小二乘(PLS)回归分析基因表达与脑结构改变的关联;最后通过单样本基因集富集分析(ssGSEA)解析细胞类型特异性基因特征,并结合Brainspan数据库追踪发育轨迹。
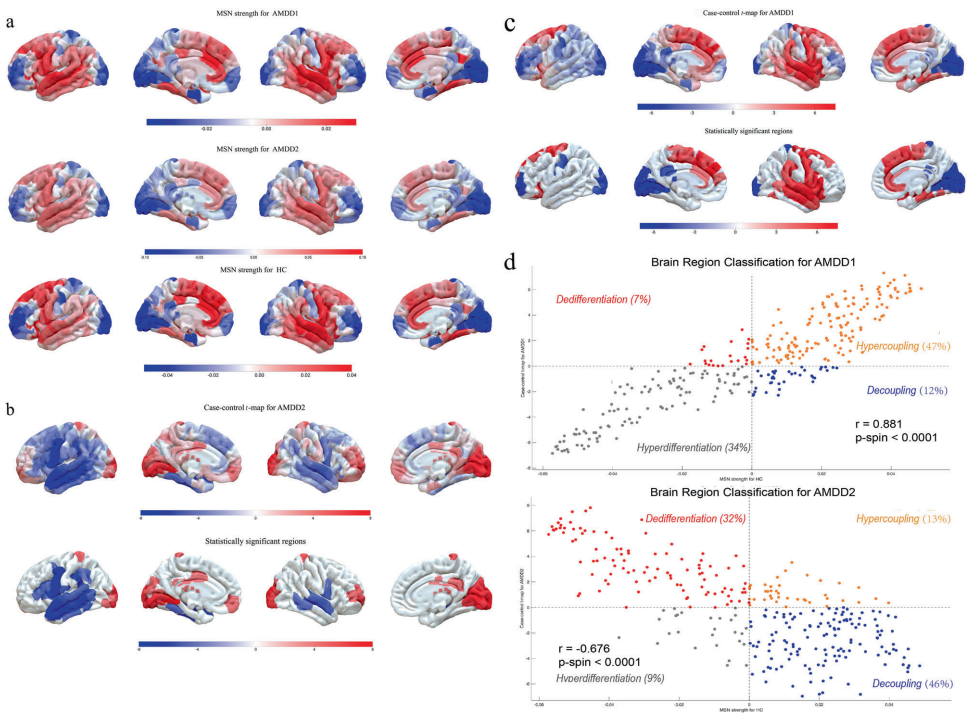
研究结果呈现出清晰的二分模式:通过"神经影像-基因表达-细胞类型-发育轨迹"的多层次分析,发现AMDD1亚型(n=86)表现为前额顶叶网络的MSN强度减弱,与星形胶质细胞相关的突触修剪基因(TAC1、CNR1)表达异常相关,临床上以冲动行为为特征但认知功能保留;AMDD2亚型(n=93)则显示边缘-视觉环路的MSN强度增强,与抑制性神经元的GABA能信号缺陷(GAD2)和MAPK通路激活有关,临床表现为严重情绪失调和沉思。两种亚型在环境敏感性上也截然不同——AMDD1对学业压力敏感,AMDD2则表现出情绪放大效应。
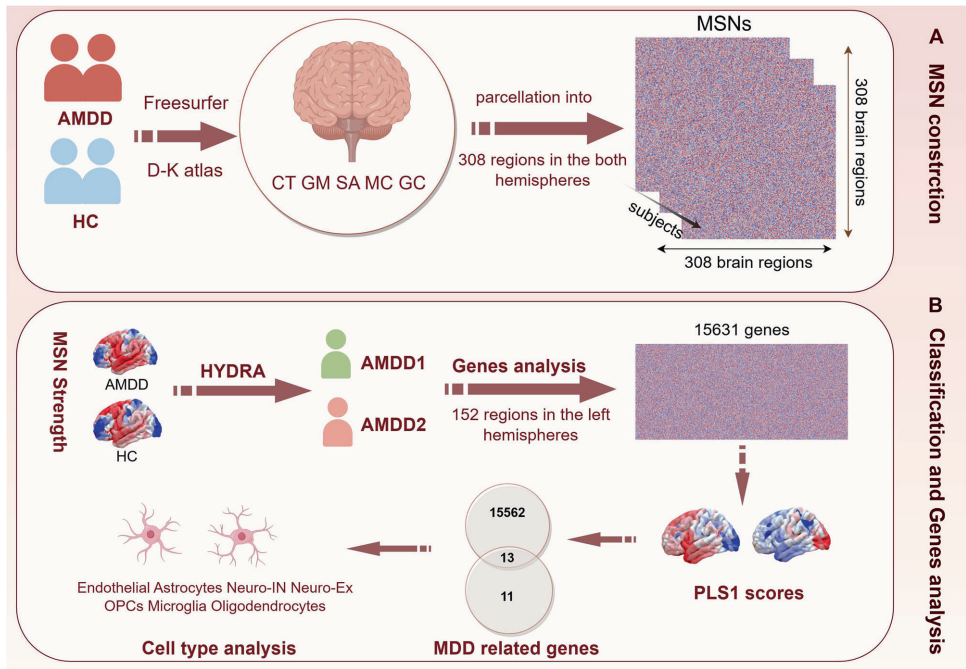
细胞类型映射揭示了更精细的病理机制:AMDD1的PLS1+基因在星形胶质细胞(230基因)和兴奋性神经元(177基因)中富集,涉及酒精代谢和泛素化等通路;而AMDD2的特征基因主要在抑制性神经元(131基因)中表达,与组蛋白去乙酰化和神经炎症相关。发育轨迹分析则发现,AMDD1相关基因在青春期杏仁核和小脑晚期发育阶段活跃,AMDD2基因则在胎儿期海马和青春期纹状体表达峰值,提示二者具有不同的神经发育起源。
这项研究的突破性发现为青少年抑郁症的精准医疗提供了路线图:对于AMDD1亚型,针对TAC1/CNR1通路的神经激肽-1受体(NK1R)拮抗剂可能改善前额叶抑制控制;而对AMDD2亚型,GAD2增强剂或MAPK抑制剂有望纠正GABA能缺陷。时间维度上,AMDD2需要胎儿期和儿童早期的预防性干预,AMDD1则需聚焦青春期的认知训练。
研究创新性地建立了"基因-细胞-网络-行为"的跨尺度关联框架,其意义不仅在于解决了临床异质性难题,更开创了将空间转录组与神经发育轨迹相结合的研究范式。正如通讯作者Yanqing Tang强调的,这项发现为理解青春期大脑如何"误入歧途"提供了分子路线图,使针对发育关键窗口的精准干预成为可能。未来,这种多模态分类方法有望扩展到其他精神障碍,推动精神病学向"生物学亚型指导下的精准治疗"时代迈进。
 生物通微信公众号
生物通微信公众号
生物通 版权所有