编辑推荐:
受损的溶酶体可以通过一种名为PITT的脂质信号通路进行修复,这种信号通路可以靶向治疗神经退行性疾病,其发现者说。
溶酶体是消化酶囊,通过分解废物来整理细胞。但它们也可能带来麻烦:当它们的外表面受损时,它们的破坏性蛋白质开始溢出到细胞质中,伤害细胞。事实上,这种渗漏的频率随着一个人年龄的增长而增加,并可能在与衰老相关的疾病中发挥作用,如神经退行性疾病。现在,9月7日发表在《自然》杂志上的一项研究揭示了细胞用来修复渗漏溶酶体的一种之前未知的途径,这可能对治疗这些疾病有意义。
丹麦癌症协会研究中心的细胞死亡和代谢教授Marja Jäättelä说,这是一项“非常完整和精心设计的”研究,也是首次将脂质运输与非代谢生物过程联系起来。Marja Jäättelä没有参与这项研究。
研究已经建立了一种细胞修复渗漏溶酶体的方法。此前,一组被称为ESCRT机制的蛋白质被发现可以修补细胞器膜上的洞。匹兹堡大学的细胞生物学家杰Jay Tan是该研究的共同作者,他认为“缺少了一些东西”。即使ESCRT复合物被抑制,高达90%的溶酶体损伤也会被修复,这表明一种不同的途径进行了大部分修复。
为了精确定位缺失通路的个别成分,Tan用一种慢病毒在人类细胞中表达一种叫做Turbo-ID的酶,这种酶能在10纳米半径内的任何蛋白质上粘贴生物素标签。使用一种定位于溶酶体的酶和一种已知能穿透溶酶体膜的化学物质,他能够对受损细胞器周围的所有蛋白质进行生物素化处理。
Tan分离出生物素标记的蛋白质,并用质谱法对其进行鉴定。在纯化的分子中有ESCRT复合物的成分,但也有已知与磷酸肌醇相互作用的蛋白质,磷酸肌醇是已知调节关键细胞过程的脂类家族,包括增殖和迁移。进一步的实验表明,当溶酶体膜受损时,一种名为磷脂酰肌醇-4-激酶2a型(PI4K2A)的酶被吸收到细胞器表面,这可能是对溶酶体中漏出的钙离子的反应,PI4K2A会产生一种叫做磷脂酰肌醇-4-磷酸(PI4P)的脂质,这种脂质作为一种危险信号,并吸收一些被称为ORPs(羟甾醇结合蛋白相关蛋白)的蛋白质,这些蛋白质将内质网与溶酶体连接起来。
这些ORPs然后将PI4P与来自内质网的脂质交换,包括磷脂酰丝氨酸,磷脂酰丝氨酸会募集脂质转运体ATG2——途径的最后组成部分。该研究的合著者、匹兹堡大学医学教授Toren Finkel说。对于脂质来说,“ATG2就像一个消防水管”,将分子泵入膜内以堵塞孔。
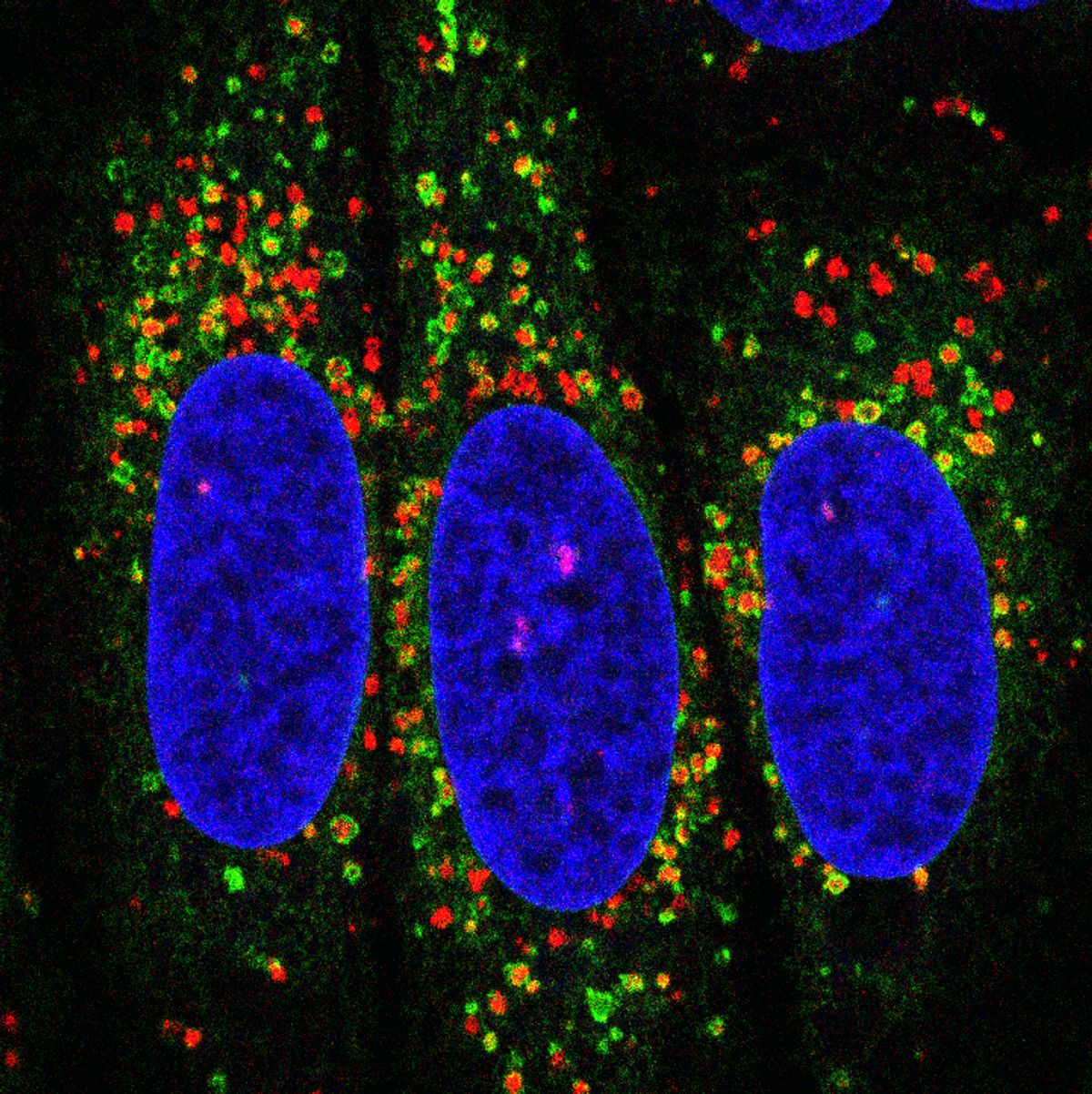
脂质从内质网(绿色)被运送到受损溶酶体(红色)的孔上。细胞核用蓝色表示。
随后,研究人员对ATG2的各种亚基进行了突变,以确认脂质转运体是该通路的重要组成部分。Finkel说:“我们通过改变氨基酸设置了一堆分子收费亭,而不是平滑的隧道,这使得脂质更难流动。”这些变化确实阻碍了细胞培养中的脂质运输和溶酶体修复。作为对匹兹堡大学的赞颂,两位科学家将这一途径命名为磷脂肌醇启动的膜系结和脂质运输,简称为PITT。
Tan认为,这两种机制可以修复不同类型的损伤,ESCRT复合体可以修复小孔隙,而PITT途径则可以修复较大的孔隙。
新的通路可能会完成细胞的大部分工作。研究人员发现,细胞通常需要大约一个小时来修复受损的溶酶体,但在缺乏PI42KA的细胞中,这种愈合需要长达11个小时。英国牛津大学药理学家Antony Galione没有参与这项研究,他说:“这看起来是一个非常重要的途径,可能比ESCRT途径更重要。”
Tan说,这一发现可能指向神经退行性疾病的药物靶点,如阿尔茨海默症,因为蛋白质聚集物如tau蛋白在溶酶体膜中逃逸,防止它们被破坏,并促进它们在神经元之间的传播。事实上,研究人员发现PI4K2A (PITT通路的启动子)的缺失增加了tau蛋白在细胞培养中的扩散。
西班牙巴塞罗那大学的分子生物学家Caroline Mauvezin没有参与这项研究,他说:“这绝对是进一步研究神经退行性变疾病模型的一个重要过程。”但这一途径在包括神经元在内的其他细胞中可能有不同的功能,因此还需要更多的研究。
研究人员计划从目前可用的可重新使用的药物开始,筛选药物激活该通路的能力。Tan说,一个有趣的线索是人参,一种用于中药的植物,其成分似乎可以激活PI42KA。
A phosphoinositide signalling pathway mediates rapid lysosomal repair
 生物通微信公众号
生物通微信公众号
生物通 版权所有