编辑推荐:
斑马鱼和小鼠模型的研究表明,靶向EGLN2可能会减少炎症并减缓ALS的进展。
肌萎缩性侧索硬化症(ALS),也被称为Lou Gehrig 's病,其特征是运动神经元的选择性丧失,导致进行性肌肉无力和瘫痪,以及吞咽和言语困难。氧化应激、代谢功能障碍和神经炎症是众所周知的ALS的特征。了解到这一点,比利时鲁汶大学VIB-KU Leuven癌症生物学中心的研究人员将一组称为EGLNs的酶作为靶标,发现下调EGLN2可以保护运动神经元,并可以减轻不同动物模型中的ALS症状。EGLNs是调节细胞炎症和代谢的代谢传感器。这项研究由Ludo Van Den Bosch博士教授领导,研究结果发表在《Cell Reports》上,题为“靶向EGLN2/PHD1保护运动神经元并使星形细胞干扰素反应正常化”。
肌萎缩性侧索硬化症(ALS)的神经炎症和能量代谢失调与运动神经元变性有关。egl-9家族的缺氧诱导因子(EGLN)酶,也被称为脯氨酸羟化酶结构域(PHD)酶,是调节细胞炎症和代谢的代谢传感器。EGLN酶的靶点是缺氧诱导因子(HIF)α,在正常有氧状态下,EGLN酶通过羟基化作用靶向HIFα进行蛋白酶体降解;在缺氧条件下,EGLN酶失去羟基化HIF的能力,从而导致HIF稳定和HIF靶点的转录,这些靶点在多种途径中发挥作用。EGLN2酶的基因消融已被证明可以通过激活HIF转录组反应来保护骨骼肌和肝细胞免受氧化应激的影响。此外,在中风模型中,EGLN2的下调通过独立于HIF的代谢重连接保护皮质神经元免受氧化应激的影响。此外,IκB激酶(IKKβ)是EGLN2.12的一个众所周知的不依赖于HIF的靶点。因此,EGLN2通过IKKβ调节活化B细胞(NF-κB)途径的核因子kappa-轻链增强子的活性,在细胞炎症反应中发挥核心作用。
研究人员使用基于寡核苷酸和遗传的方法,在两种ALS斑马鱼模型中靶向EGLN2——在这些斑马鱼模型中注射人类突变体SOD1G93A (SOD1G93A)和91个拷贝的C9orf72正义重复(91S) RNA,它们出现了运动轴突病,轴突长度减少,轴突异常分支的比例增加。
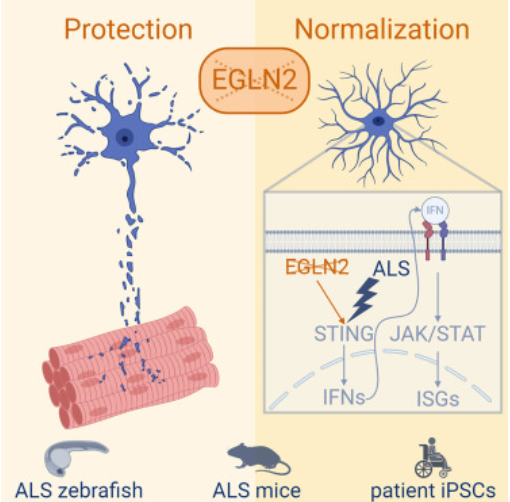
通过注射针对EGLN2的外显子2/内含子2剪接的反义寡核苷酸morpholino (AMO)来实现去除外显子2,而不影响EGLN1a和-b以及EGLN3的mRNA水平,实现EGLN2的下调。研究人员发现,下调EGLN2可以保护运动神经元,并可以减轻斑马鱼和小鼠模型中的ALS表型——几乎完全挽救了运动轴突的异常,增加了轴突长度,减少了运动轴突的异常分支。EGLN2的缺失还延长了SOD1G93A小鼠的存活时间,减轻了运动神经元的退化。
他们还发现EGLN2影响星形胶质细胞的促炎级联反应,星形胶质细胞是一种支持运动神经元的脑细胞。小鼠脊髓的单核RNA测序显示,EGLN2的缺失诱导星形胶质细胞特异性的干扰素刺激基因下调,这是通过干扰素基因刺激因子(STING)蛋白介导的。EGLN2基因缺失在ALS患者来源的诱导多能干细胞(iPSC)衍生的星形胶质细胞中恢复了干扰素应答的正常化,证实了EGLN2与星形胶质细胞干扰素信号传导之间的联系。
此前,VIB-KU Leuven癌症生物学中心的Peter Carmeliet医学博士和教授的实验室探索了EGLN2酶在低氧水平细胞中的作用。研究表明,抑制EGLN2可保护肌肉细胞、肝细胞和皮质神经元免受氧化应激。
该研究的第一作者、博士生Christine Germeys说:“我们使用了一种多模型方法来研究EGLN2在不同细胞类型中的作用。”“我们包括斑马鱼、小鼠和来自ALS患者的诱导多能干细胞(iPSCs),并使用单核RNA测序来了解EGLN2调控背后的潜在过程。”
“靶向EGLN2可能代表了一种很有前途的治疗ALS的策略,”Van Den Bosch补充说。“虽然还需要进一步的研究,但这一发现使我们更接近于了解如何减缓或预防这种毁灭性疾病。”
生物通 版权所有