编辑推荐:
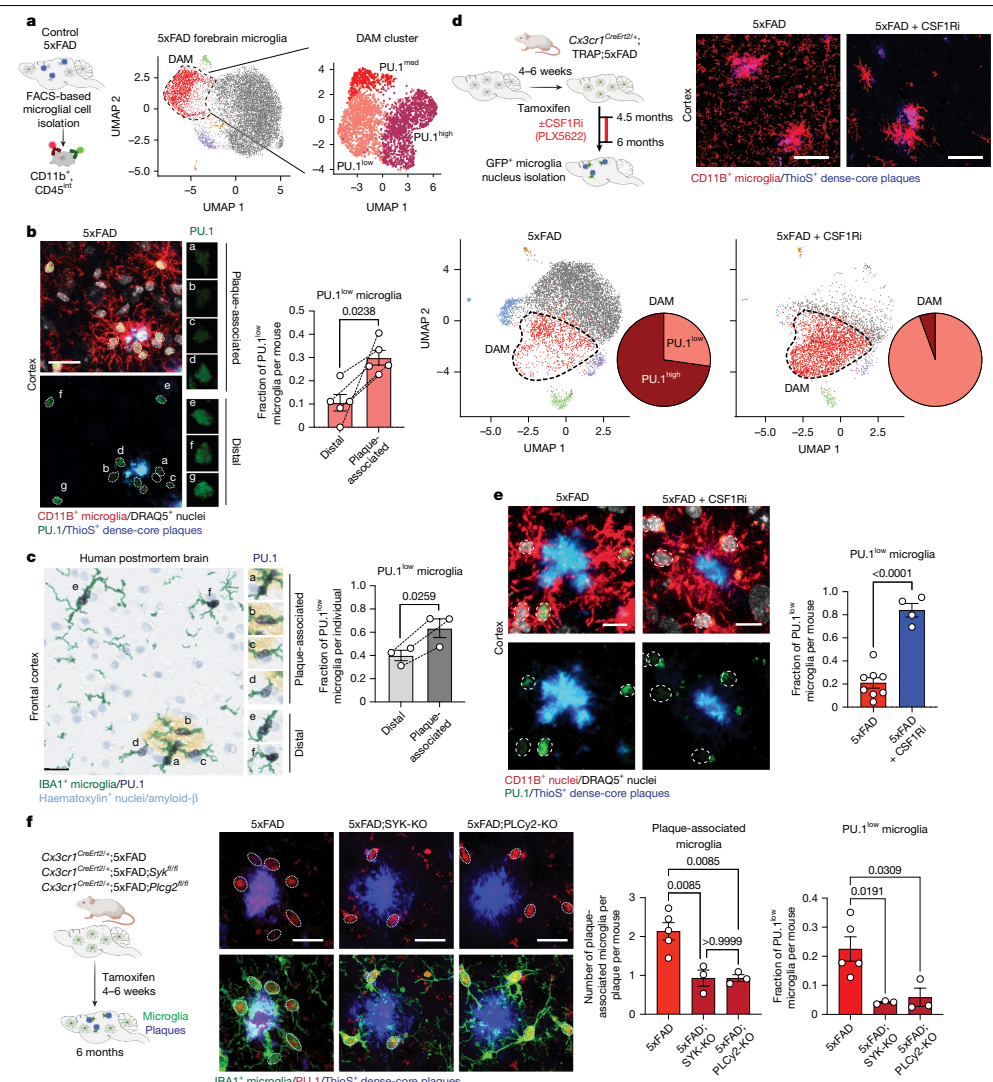
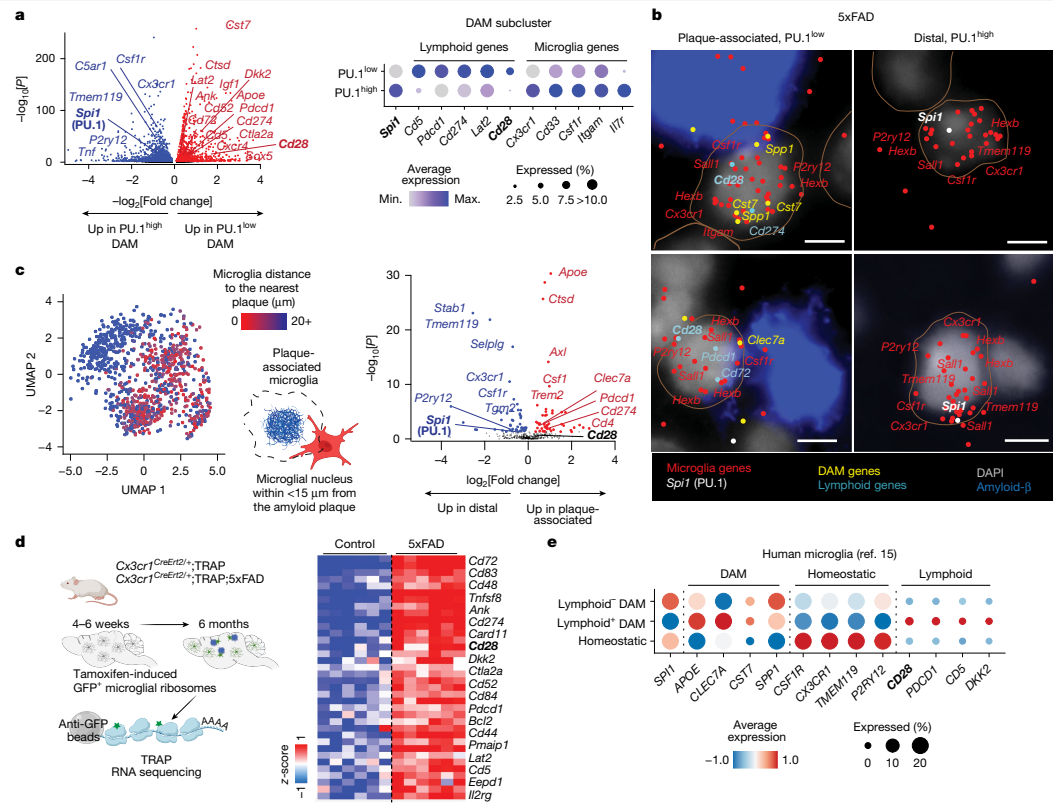
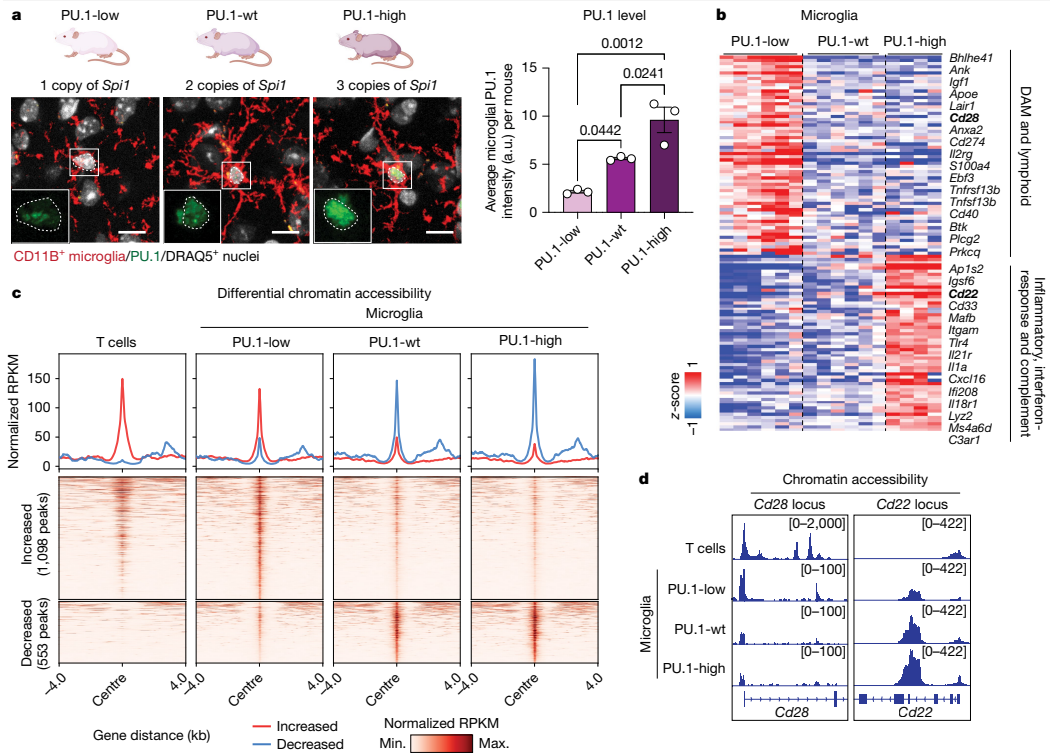
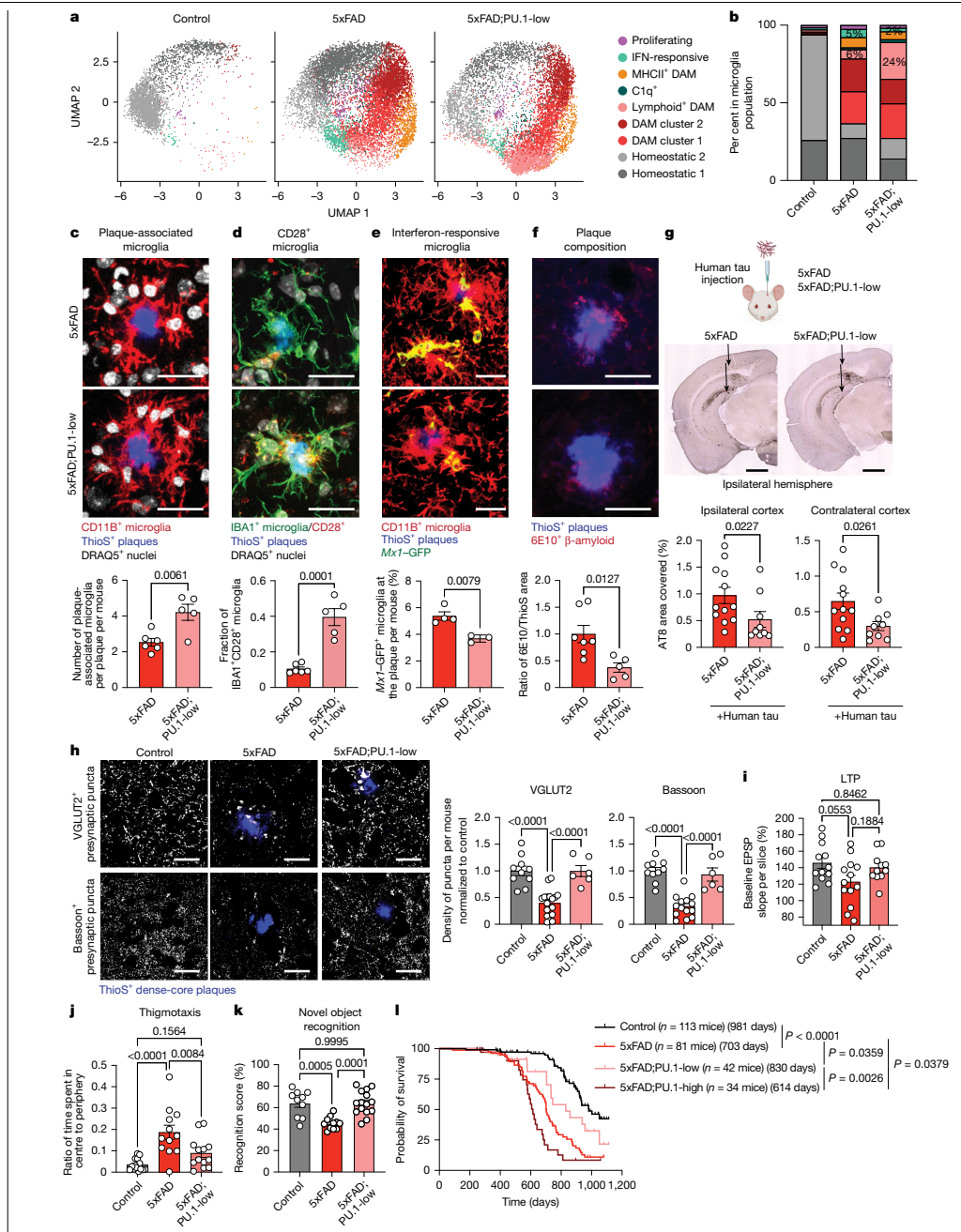
本研究针对阿尔茨海默病(AD)中小胶质细胞功能失调的关键问题,通过单细胞测序、空间转录组学和基因编辑技术,首次发现PU.1转录因子下调可诱导小胶质细胞表达CD28等淋巴样受体,形成神经保护性表型。该研究揭示了PU.1lowCD28+小胶质细胞通过抑制神经炎症、促进淀粉样斑块清除和改善突触功能,显著延缓5xFAD小鼠疾病进展。这一发现为AD免疫治疗提供了新靶点。
 生物通微信公众号
生物通微信公众号
生物通 版权所有