编辑推荐:
本研究针对多发性骨髓瘤(MM)治疗中达雷妥尤单抗(Dara)获得性耐药难题,通过单细胞RNA测序(scRNA-seq)和数字空间分析(DSP)技术,首次揭示骨髓免疫微环境中CD8+T细胞耗竭表型通过IFN-γ/MYC轴驱动耐药的新机制。研究人员发现耐药样本中GNLY+/GZMK+ CD8+T细胞扩增伴随MYC调控的核糖体生物合成通路激活,MYC抑制剂(MYCi975)可逆转耐药,为临床联合治疗提供新靶点。
多发性骨髓瘤(MM)作为血液系统第二大恶性肿瘤,尽管抗CD38单抗达雷妥尤单抗(Daratumumab, Dara)显著改善了患者预后,但获得性耐药仍是临床重大挑战。既往研究多聚焦于肿瘤细胞自身CD38表达下调或克隆演化,而对骨髓免疫微环境在耐药中的作用知之甚少。这一领域的研究空白,使得破解耐药机制如同试图解开没有线头的死结。
中山大学肿瘤防治中心的研究团队在《Leukemia》发表的研究中,采用多组学联用策略,首次绘制出Dara耐药过程中骨髓免疫生态系统的动态重塑图谱。研究人员收集6例MM患者配对样本(治疗前vs耐药期),通过10x Genomics单细胞转录组测序分析92,472个细胞,结合GeoMx数字空间分析技术,发现CD8+T细胞耗竭表型扩增与MYC激活构成耐药核心机制。关键实验技术包括:单细胞转录组测序解析细胞异质性;PrimeFlow RNA流式验证T细胞表型转换;数字空间分析定位肿瘤中心/边缘免疫特征;体外ADCC/CDC实验验证MYC抑制剂增敏效应;NCG小鼠模型模拟临床耐药。
scRNA-seq profiling
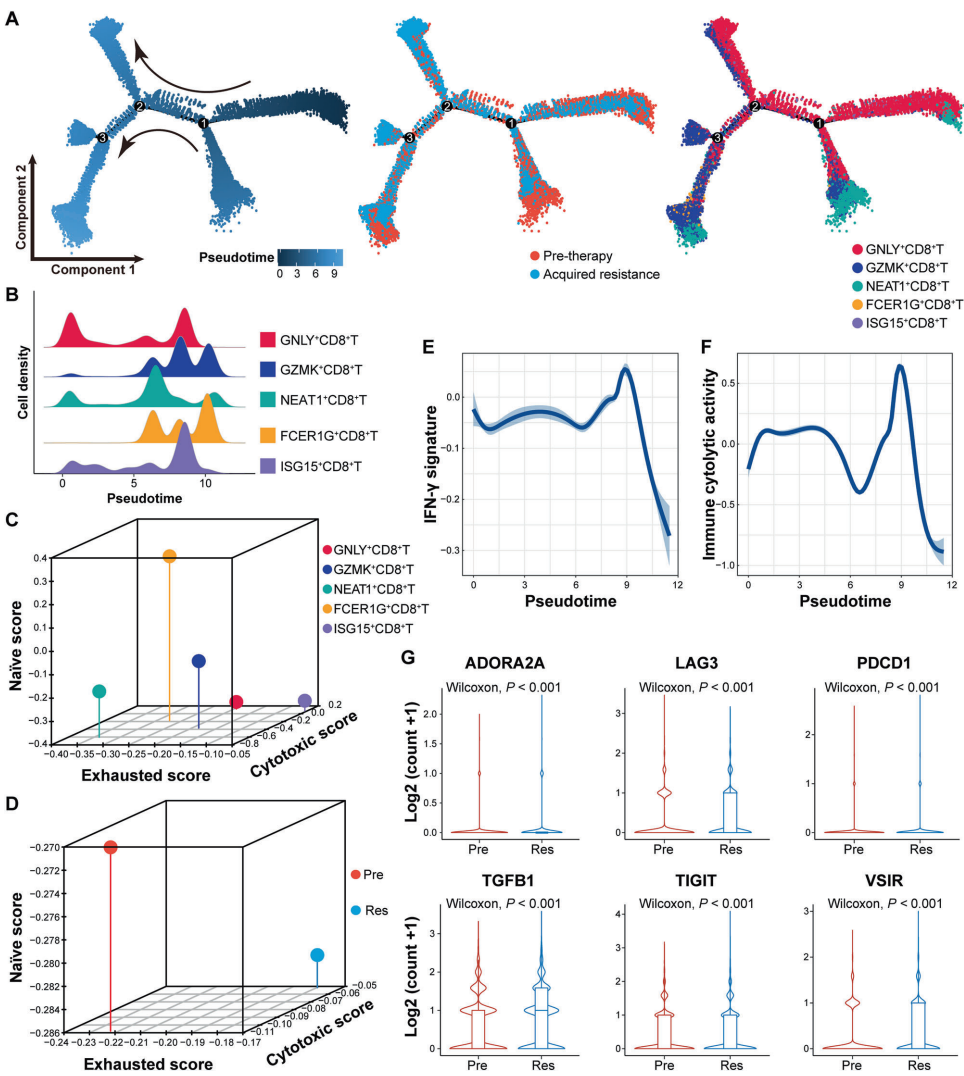
分析显示耐药样本中细胞毒性CD8+T细胞(GNLY+、GZMK+)比例显著增加(P<0.001),伴随耗竭标志物TIGIT/LAG3上调。伪时序分析揭示这些细胞处于终末分化状态,持续分泌IFN-γ但伴随功能衰竭。
Neoplastic plasma cells
恶性浆细胞聚类发现9个亚群,耐药样本中簇2/5/7/8显著扩增(P<0.001)。这些亚群高表达核糖体基因(簇2)和细胞周期基因(簇7),SCENIC分析揭示其受MYC调控网络驱动。
Spatial variation
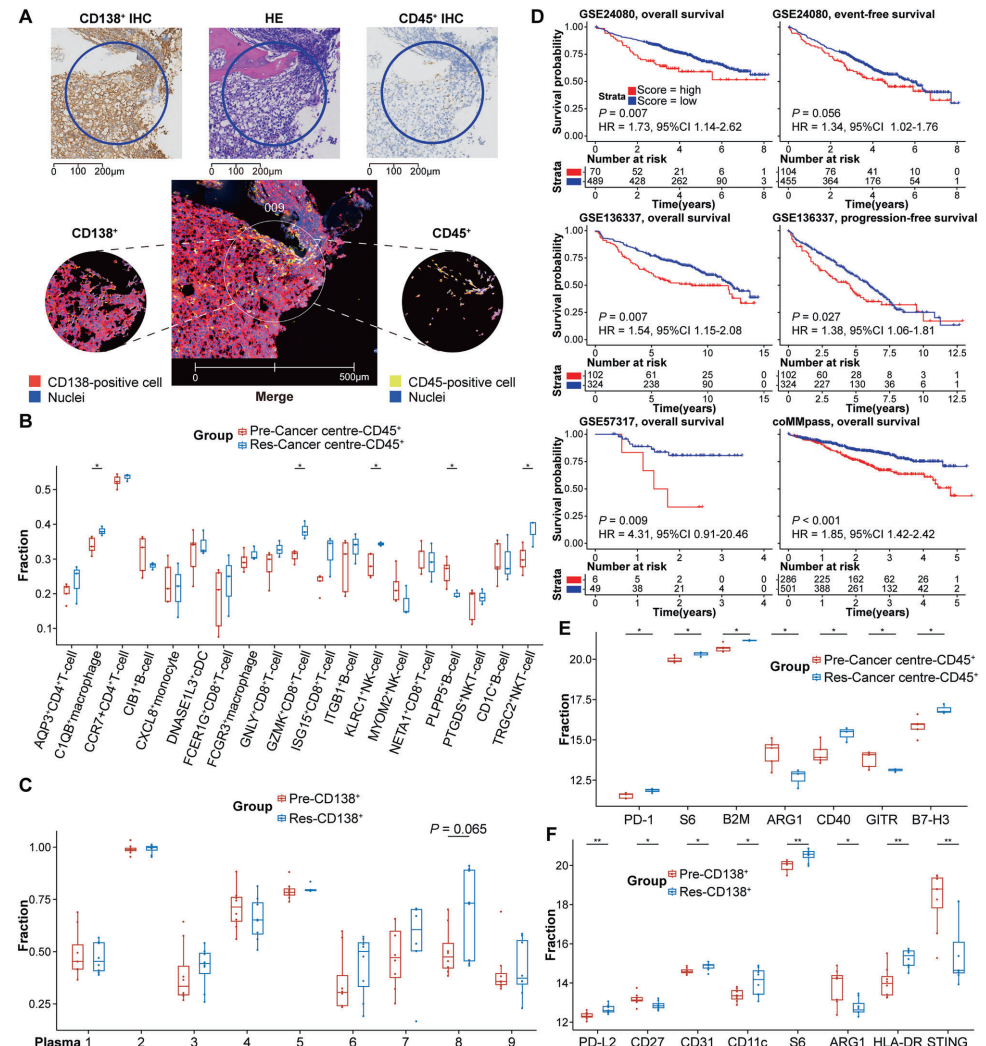
数字空间分析显示肿瘤中心区CD45+免疫细胞减少50%,但耗竭评分增加3倍(P<0.05)。关键验证发现MYC过表达使Dara的CDC半数有效浓度(EC50)从58.28μg/ml升至116.08μg/ml(P=0.002),而MYCi975可逆转此效应。
这项研究开创性地提出"免疫压力- MYC激活"双驱动耐药模型:细胞毒性T细胞持续分泌IFN-γ激活MYC,进而通过核糖体生物合成(簇2)和代谢重编程(簇8)促进肿瘤存活。临床转化价值在于:① MYC抑制剂联合方案可使ADCC效率提升189.48%(P<0.001);② 建立的100基因耐药特征在4个独立队列(n=1827)中预测生存(HR=1.39-4.31);③ 空间分析指导精准免疫治疗靶向。该成果为逆转Dara耐药提供了全新的干预策略和生物标志物体系。
 生物通微信公众号
生物通微信公众号
生物通 版权所有