编辑推荐:
本研究针对目前尚无有效治疗手段的GM2神经节苷脂贮积症(包括Tay-Sachs病和Sandhoff病),通过双载体rAAVrh8-HEXA/rAAVrh8-HEXB联合双侧丘脑注射+脑池/鞘内给药方案,在9例患者中证实了剂量依赖性的HexA酶活性恢复(最高达正常值13%)和GM2水平下降,婴儿患者表现出喂养能力延长和癫痫发作改善等临床获益,为这类致命性溶酶体贮积症提供了新的治疗方向。
在儿童神经退行性疾病领域,GM2神经节苷脂贮积症(GM2 gangliosidosis)始终是医学界难以攻克的堡垒。这类由HEXA或HEXB基因突变导致的溶酶体贮积症,根据发病年龄可分为婴儿型(5-6个月起病,3-6岁死亡)和青少年型(第二十年死亡),共同特征是中枢神经系统(CNS)中GM2神经节苷脂的异常堆积。尽管科学家们已阐明其病理机制——缺乏功能性β-氨基己糖苷酶A(HexA)导致GM2降解障碍,但二十年来始终没有突破性疗法问世。面对这一困境,来自美国马萨诸塞大学医学院(UMass Chan Medical School)的研究团队在《Nature Medicine》发表了一项开创性研究,通过创新的双载体腺相关病毒(AAV)基因治疗策略,为这类"无药可治"的遗传病带来了曙光。
研究人员采用rAAVrh8血清型载体分别携带HEXA和HEXB基因,通过双侧丘脑(BiT)对流增强给药联合脑池(IC)及鞘内(IT)注射的创新给药方案,在9例患者(6例婴儿型,3例青少年型)中开展剂量递增试验。关键技术包括:1)四组剂量设计(丘脑注射体积从180μl递增至1,250μl);2)免疫抑制方案(利妥昔单抗+西罗莫司+糖皮质激素);3)多模态评估体系(CSF HexA活性、血清总Hex活性、GM2质谱检测、DTI纤维示踪等);4)自然史数据对照分析。
剂量依赖性生化改善
CSF中HexA活性在TSD婴儿患者呈现明显剂量效应,高剂量组(1,250μl/丘脑)12周时达峰值0.59 nmol h-1ml-1(正常值4.57±1.80)。血清总Hex活性突破40 nmol h-1ml-1>(正常下限2倍)。质谱分析显示C20:0 GM2在4例婴儿患者最大降幅达52.5%,与HexA活性变化同步。
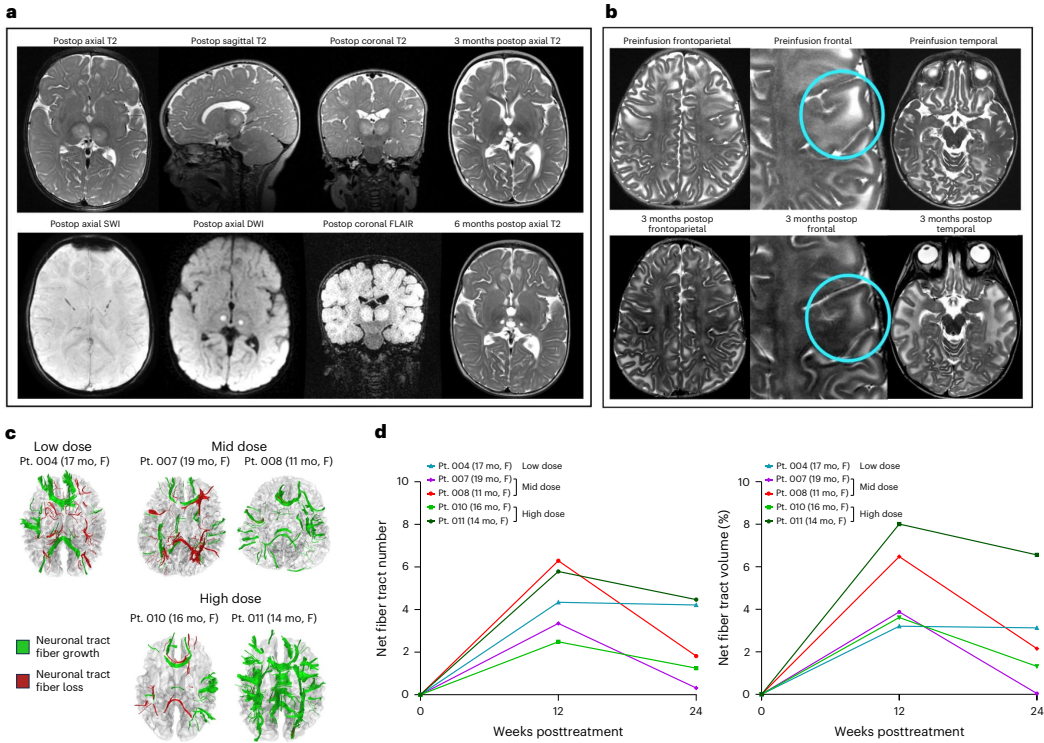
神经影像学证据
DTI差异示踪技术发现治疗后12周出现新增髓鞘纤维束(图1c绿色部分),主要分布于胼胝体和大脑叶,但24周时部分消退。脑体积增长率较历史数据降低超50%,提示GM2贮积减缓。值得注意的是,高剂量组两例患者小脑皮层体积减少10-15%,可能反映治疗特异性效应。
临床结局分化
婴儿患者获得关键功能改善:高剂量组维持经口喂养至27个月(历史对照13-18个月需胃造瘘),癫痫发作更晚、更轻且更易控制。但青少年患者出现意外的不良事件——3例中2例出现肌张力障碍加重,可能与丘脑-基底节环路改变有关,这促使研究者调整方案仅纳入婴儿患者。

这项研究开创性地证实了双AAV载体联合CNS多途径给药的可行性,尽管疗效持续时间有限(峰值在12周,24周下降),但为后续开发"all-in-one"双顺反子载体提供了关键剂量参考。特别值得注意的是,该方案突破了AAV基因治疗在全局性CNS疾病中的递送瓶颈——通过丘脑神经元的轴突运输实现酶蛋白的广泛分布,这一发现对其他类似疾病(如黏多糖贮积症)的治疗具有启示意义。研究同时警示了青少年患者运动障碍风险,强调了个体化治疗方案的重要性。随着后续双基因载体的优化和给药方案的改进,这项成果有望改写GM2神经节苷脂贮积症的治疗格局。
 生物通微信公众号
生物通微信公众号
生物通 版权所有