编辑推荐:
研究人员开发了单细胞DNA-RNA联合测序技术(SDR-seq),解决了传统方法无法在单细胞水平同时检测基因组变异(gDNA)和基因表达(RNA)的技术瓶颈。该技术通过微流控液滴系统同时分析480个基因组位点和转录本,准确鉴定编码区和非编码区变异的合子状态及其对基因表达的调控作用。在iPS细胞和B细胞淋巴瘤原代样本中,成功将BCL2等变异与肿瘤发生相关信号通路关联,为解析疾病相关遗传变异的分子机制提供了全新平台。
在基因组医学时代,超过90%的疾病相关变异位于非编码区,但解析这些变异的功能影响仍面临重大挑战。传统CRISPR筛选和报告基因系统存在内源基因组环境缺失、编辑效率低等技术瓶颈,而现有单细胞多组学技术又受限于等位基因丢失率高(>96%)和检测通量不足。这些限制严重阻碍了科学家系统研究遗传变异如何通过调控基因表达影响疾病进程。
为突破这些限制,由欧洲分子生物学实验室(EMBL)主导的国际团队在《Nature Methods》发表了创新性单细胞DNA-RNA联合测序技术SDR-seq。该研究通过巧妙整合微流控液滴系统与多重PCR技术,首次实现单细胞水平基因组变异与转录组的同步高灵敏度检测。研究团队来自德国、美国、芬兰等多国机构,包括Dominik Lindenhofer、Julia R. Bauman等16位合作者。
关键技术方法包括:(1)建立基于乙二醛固定的单细胞共固定技术,平衡gDNA和RNA保存效果;(2)开发原位逆转录与液滴内多重PCR联用方案,实现480个靶标同步检测;(3)设计特异性引物区分gDNA(R2N)和RNA(R2)文库;(4)应用Tapestri微流控平台完成高通量单细胞分选;(5)利用原发性B细胞淋巴瘤样本(3例)验证临床适用性。
【Droplet-based SDR-seq】部分验证了技术可行性。比较乙二醛和甲醛固定效果发现,乙二醛处理的细胞RNA目标检测率提高1.6倍,而gDNA目标检测保持稳定(82%)。物种混合实验显示RNA交叉污染仅0.8-1.6%,且可通过样本条码校正。
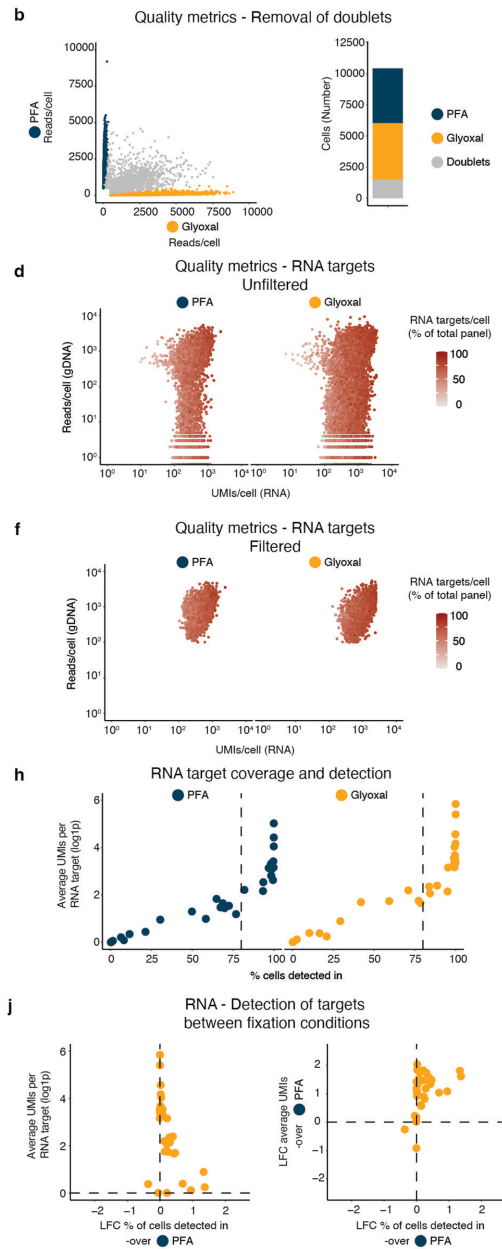
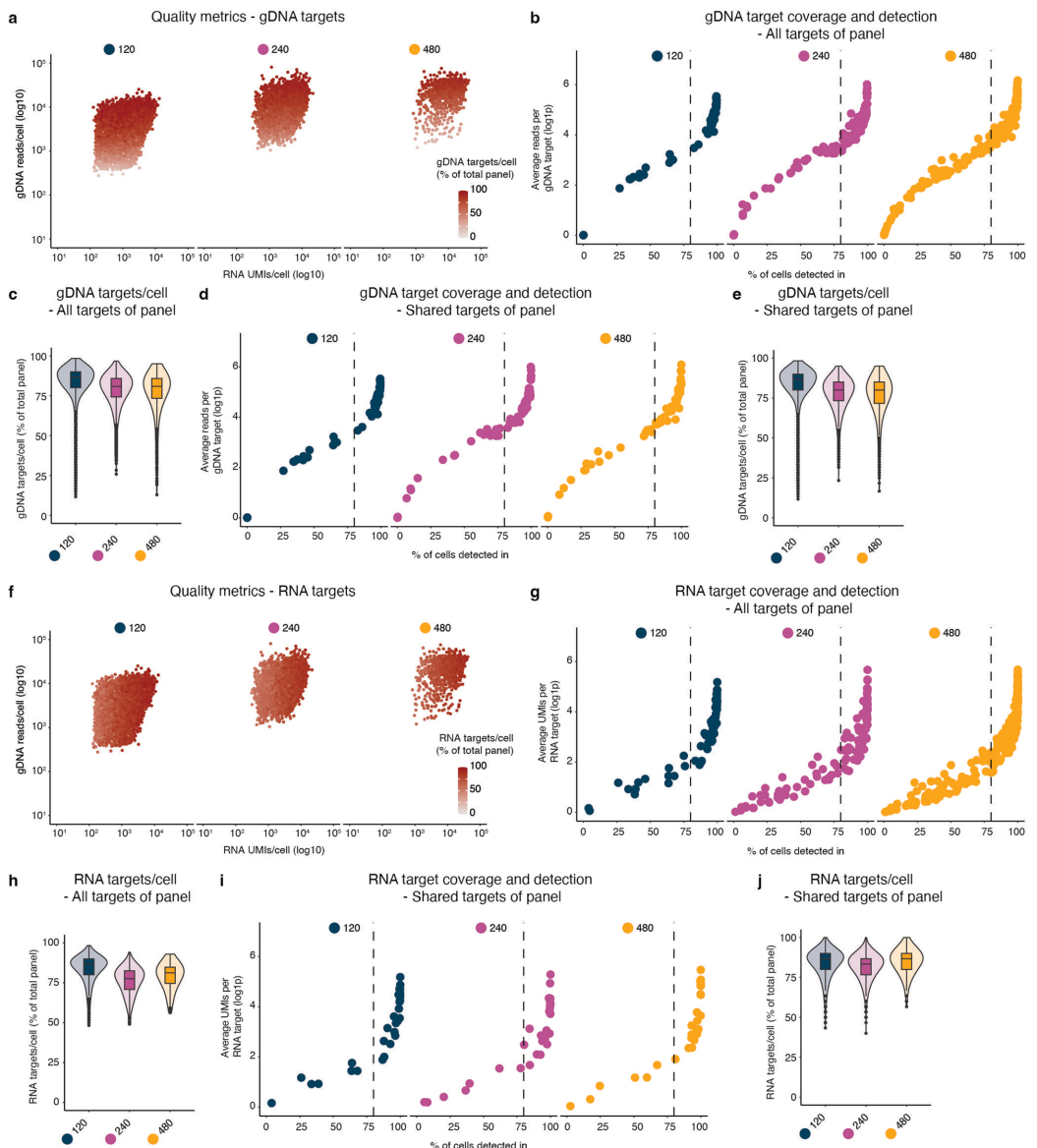
【SDR-seq is scalable to hundreds of gDNA loci and genes】展示了技术扩展性。在120-480个靶标的面板测试中,80%gDNA目标在>80%细胞中稳定检出,等位基因丢失率仅6-13%,显著优于现有技术。染色质状态分析表明,不同调控元件(如增强子dELS)的检测效率无显著差异。
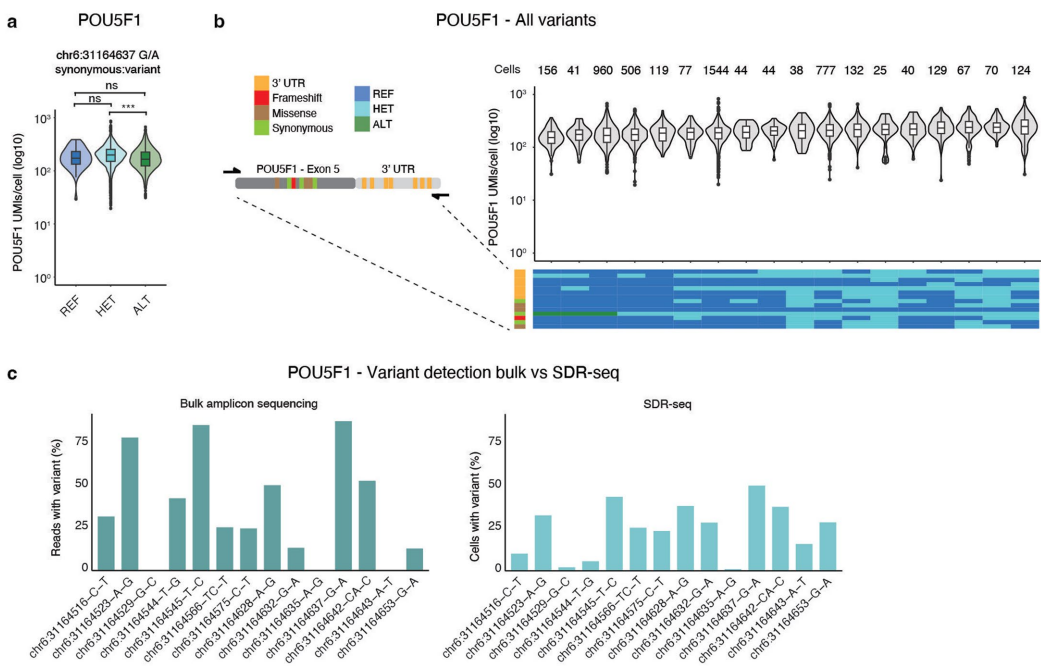
【SDR-seq confidently detects gene expression changes】通过CRISPRi和碱基编辑(BE)验证灵敏度。靶向转录起始位点(TSS)的gRNA使95%目标基因表达显著下调,而24%eQTLs也显示调控效应。在POU5F1位点发现3'UTR变异组合可显著影响基因表达,凸显内源环境研究的重要性。
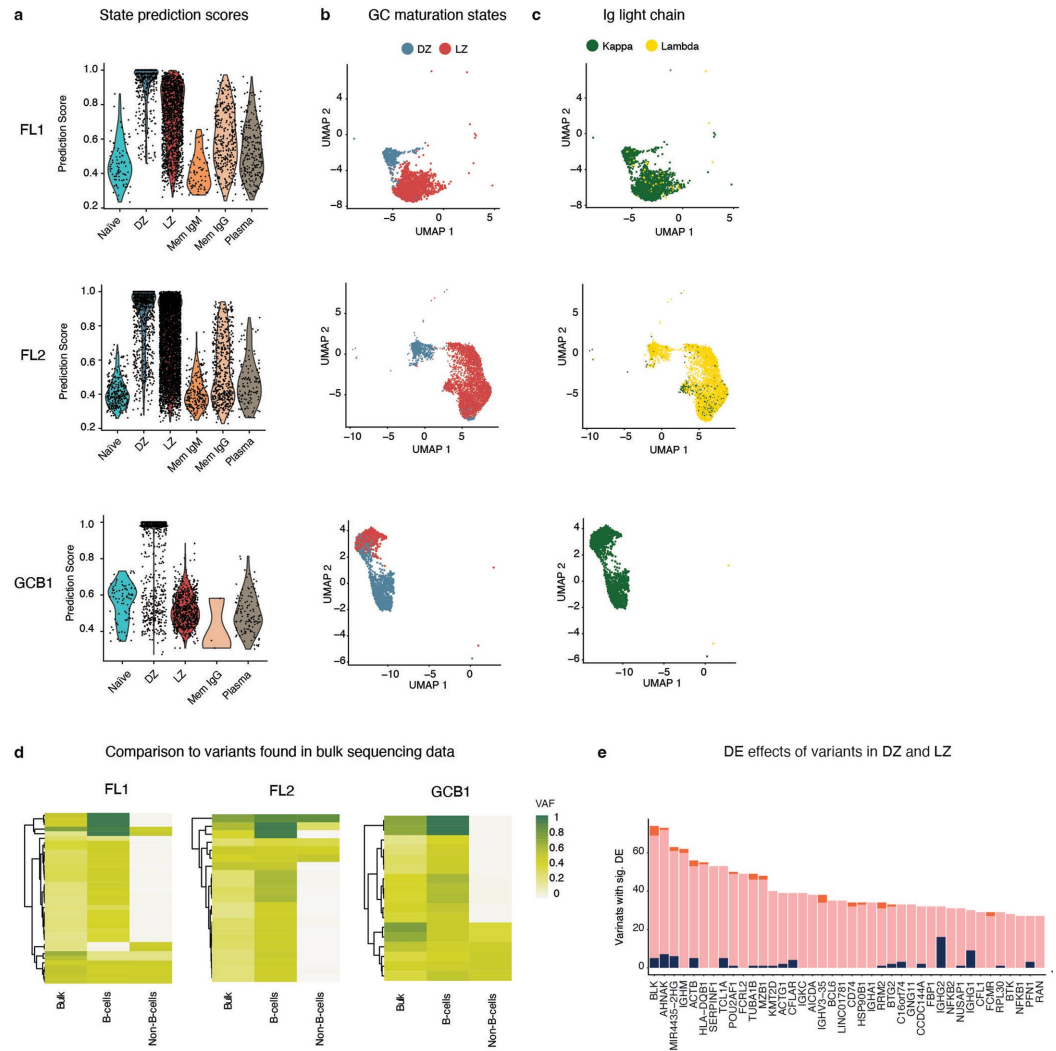
【B cell lymphoma variants linked to tumorigenic expression】部分展示了临床应用价值。在滤泡性淋巴瘤(FL)和弥漫大B细胞淋巴瘤(GCB)样本中,SDR-seq成功解析了暗区(DZ)和明区(LZ)细胞的克隆演化,发现BCL2变异在LZ显著富集(P<0.05)。高突变负荷细胞显示B细胞受体(BCR)信号通路激活,为肿瘤免疫逃逸机制提供新见解。
研究结论指出,SDR-seq通过三大创新突破现有技术局限:(1)将等位基因检测准确率提升至87-94%,比现有方法降低6-10倍错误率;(2)实现非编码变异与基因表达的精准关联,填补GWAS研究的功能空白;(3)在原发性肿瘤样本中解析克隆演化与细胞状态的关系。该技术为精准医学研究提供了全新工具,未来可拓展至线粒体基因组分析和蛋白质组联合检测等领域。正如通讯作者Lars M. Steinmetz强调的,这项技术将推动"从遗传变异到分子表型"的系统解析,为复杂疾病机制研究和治疗靶点发现开辟新途径。
 生物通微信公众号
生物通微信公众号
生物通 版权所有