在我们身体的微观世界里,肠道菌群扮演着“隐形工程师”的角色,它们不仅帮助消化食物,更通过产生大量代谢产物远程调控着全身的免疫系统。然而,这些微生物信使如何影响远离肠道的器官(如肺部)的免疫状态,至今仍是科学界亟待破解的谜题。特别是在新冠肺炎(COVID-19)等呼吸道疾病中,临床观察发现重症患者体内次级胆汁酸水平显著降低,这提示我们:菌群代谢物可能掌握着肺部免疫调控的关键钥匙。
带着这样的思考,波兰科学院尼基实验生物学研究所的Tomasz P. Wypych团队在《Signal Transduction and Targeted Therapy》上发表了一项开创性研究。他们发现了一种名为isolithocholic acid (isoLCA) 的肠道菌群依赖性胆汁酸,能够像一把精准的钥匙,打开肺部免疫调控的大门。这项研究不仅揭示了菌群-肺轴调控的新机制,更开创了通过代谢重编程治疗肺部炎症性疾病的新范式。
研究人员运用多学科技术手段展开探索。在细胞模型方面,采用脂多糖(LPS)刺激的小鼠原代肺免疫细胞和人单核细胞来源的巨噬细胞(MDMs)评估胆汁酸的抗炎活性;在动物模型方面,建立LPS诱导的急性肺损伤和呼吸道感染模型,通过鼻腔给予isoLCA观察治疗效果;在机制研究方面,结合荧光激活细胞分选(FACS)、单细胞RNA测序(scRNA-seq)、qPCR和药理学抑制实验,深入解析isoLCA的作用靶点和信号通路。所有人类样本均来自健康供体,动物实验均经过伦理委员会批准。
isolithocholic acid (isoLCA) 靶向肺部免疫
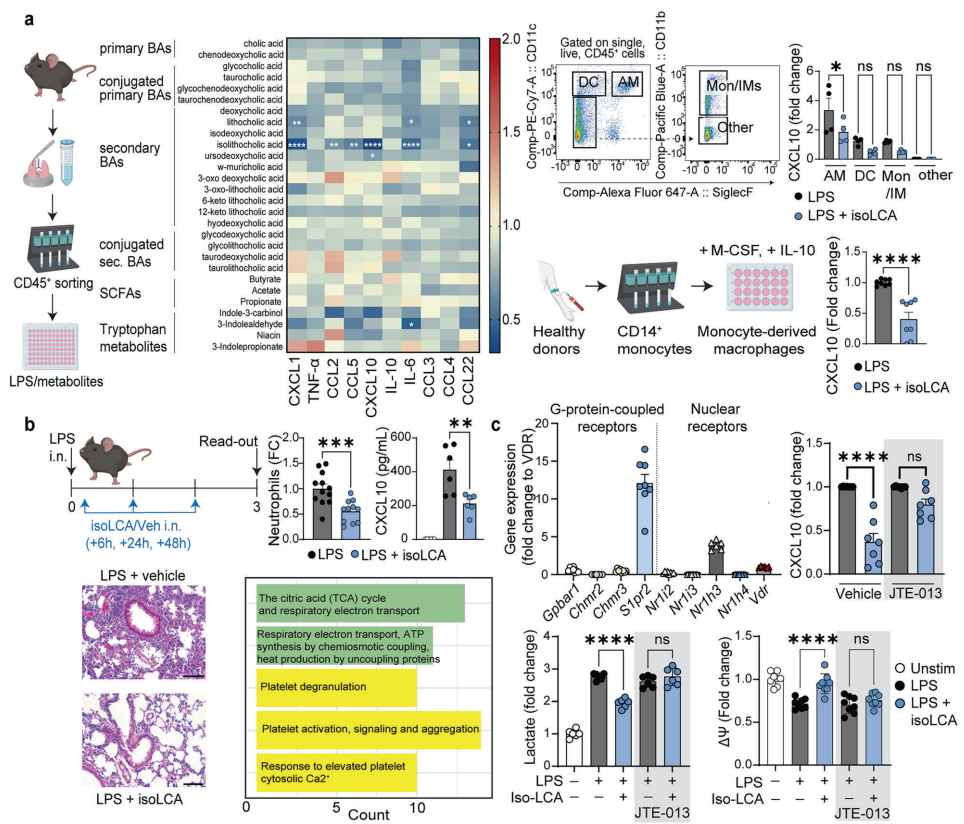
研究人员首先筛选了多种胆汁酸对肺部免疫细胞的调节作用。令人惊喜的是,在LPS刺激的小鼠原代肺免疫细胞中,isoLCA表现出最强的抗炎活性,能显著抑制炎症因子CXCL10的产生。通过精细的细胞分选技术,他们发现肺泡巨噬细胞是isoLCA的主要作用靶点,这一现象在人类巨噬细胞模型中也得到验证。
isoLCA通过S1PR2受体介导代谢重编程
为了解开isoLCA的作用机制,研究团队检测了巨噬细胞中胆汁酸受体的表达谱。结果表明,鞘氨醇-1-磷酸受体2 (S1PR2) 表达水平最高,提示其可能是isoLCA的信号传导媒介。当使用选择性拮抗剂JTE-013阻断S1PR2后,isoLCA的抗炎效应被完全消除,同时乳酸产生恢复正常,线粒体膜电位得以维持,这充分证实了S1PR2在isoLCA信号通路中的核心地位。
isoLCA在肺部疾病模型中的治疗潜力
在急性肺损伤模型中,鼻腔给予isoLCA显著降低了支气管肺泡灌洗液(BALF)中的中性粒细胞浸润和CXCL10水平,肺部炎症浸润明显改善。单细胞RNA测序进一步显示,isoLCA处理引起了肺泡巨噬细胞的深度转录组变化,特别是三羧酸循环(TCA cycle)相关基因的上调,揭示了代谢重编程在其中的关键作用。在呼吸道感染模型中,isoLCA治疗不仅减少了炎症细胞浸润,还降低了BALF中的乳酸浓度,改善了气道上皮屏障功能,甚至调节了纵隔淋巴结中CD4+ T细胞和B细胞的数量,表明其对先天免疫和适应性免疫均有广泛调节作用。
这项研究的重要意义在于建立了菌群代谢物与肺部免疫之间的完整调控轴线。isoLCA-S1PR2-代谢重编程轴心的发现,为理解菌群-肺轴提供了全新的分子框架。从转化医学视角,该研究不仅为呼吸道炎症性疾病提供了潜在治疗策略,还将胆汁酸的结构多样性确立为发现新型免疫代谢调节剂的宝贵平台。更值得关注的是,研究团队验证了临床观察背后的科学机制,为未来开发靶向代谢的抗炎药物奠定了坚实基础。这项工作完美诠释了“从临床中来,到临床中去”的研究理念,为免疫代谢领域开辟了新的方向。
打赏