编辑推荐:
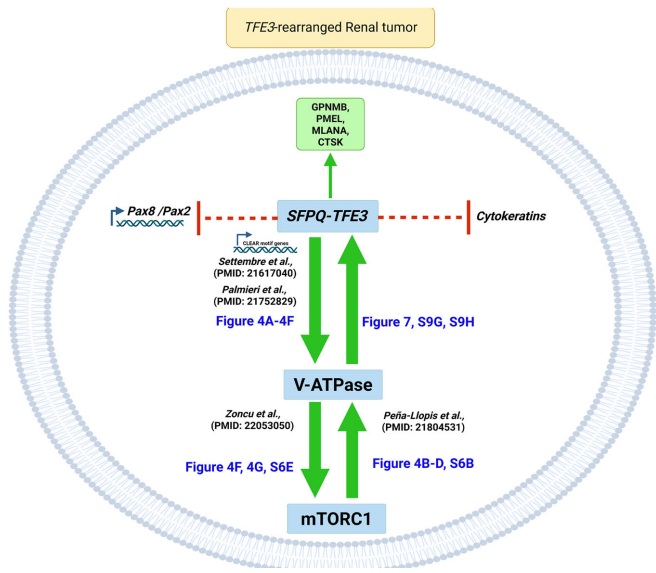
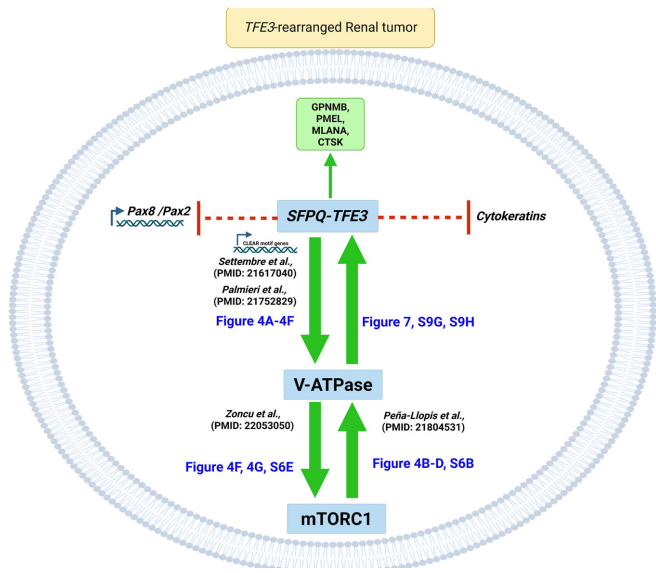
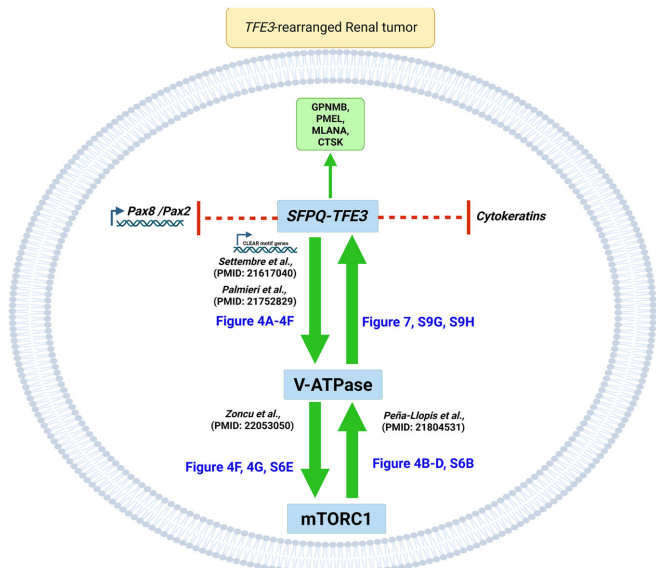
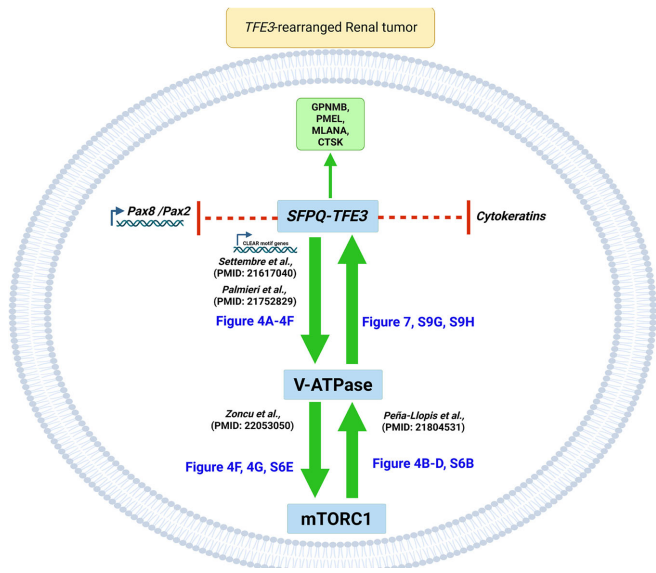
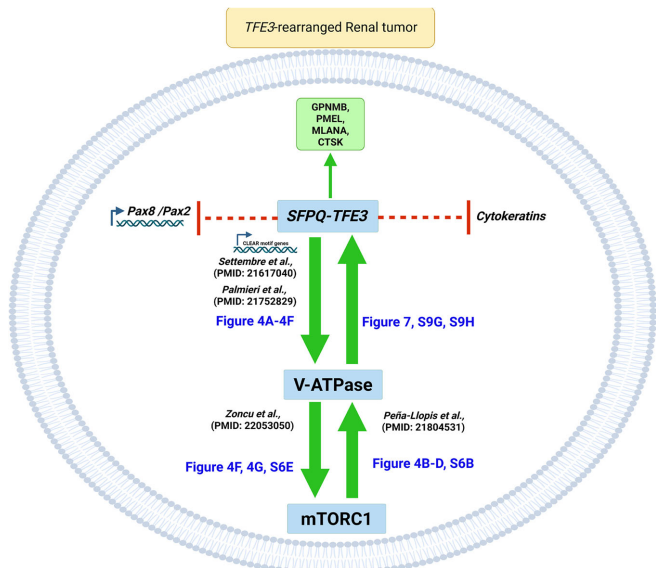
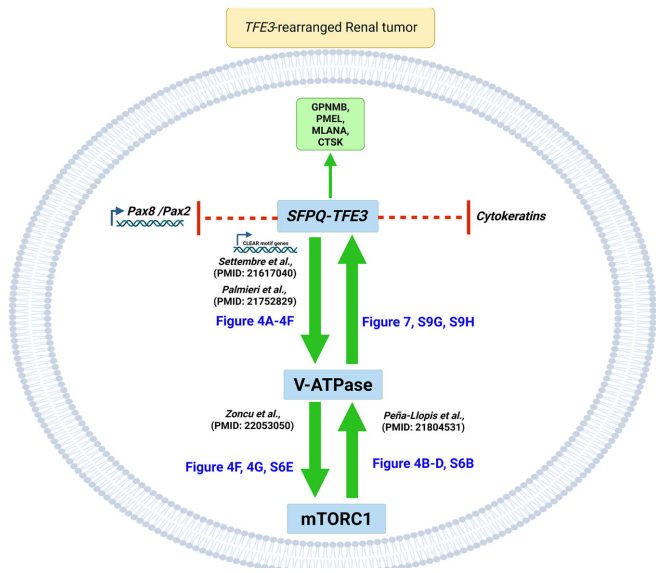
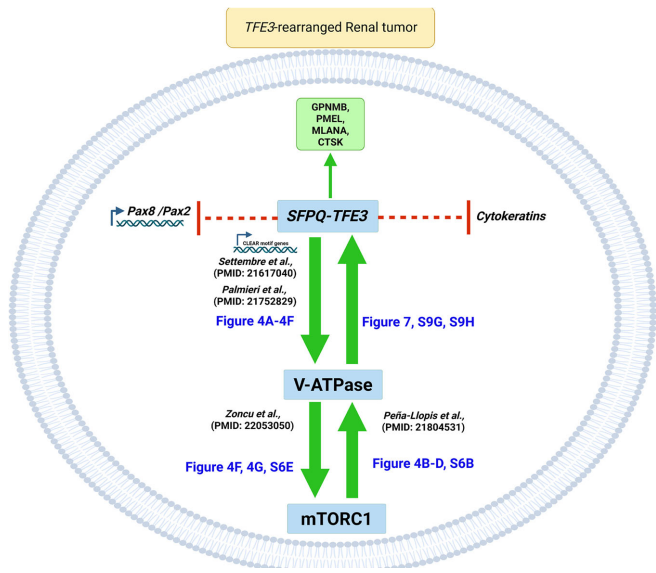
本研究针对TFE3基因融合肾癌的谱系可塑性机制,通过构建新型SFPQ-TFE3转基因小鼠模型,首次证实该融合基因可驱动肾小管上皮细胞向PEComa表型转分化。研究发现SFPQ-TFE3通过上调V-ATPase表达激活mTORC1信号,进而形成正向反馈环路抑制PAX8/PAX2肾系转录因子表达。mTOR抑制剂可逆转这一过程,为临床治疗提供新策略。论文发表于《Nature Communications》。
 生物通微信公众号
生物通微信公众号
生物通 版权所有