编辑推荐:
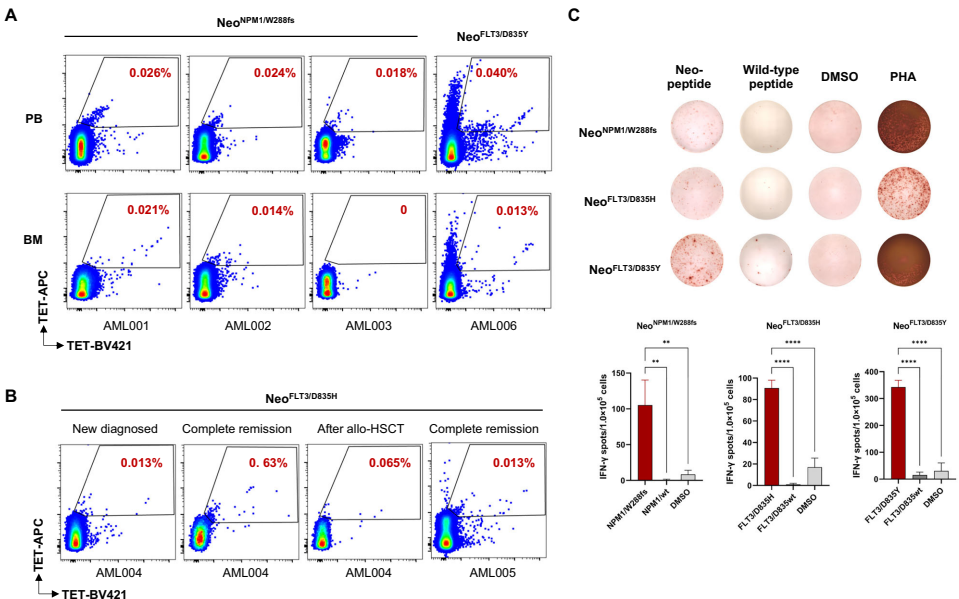
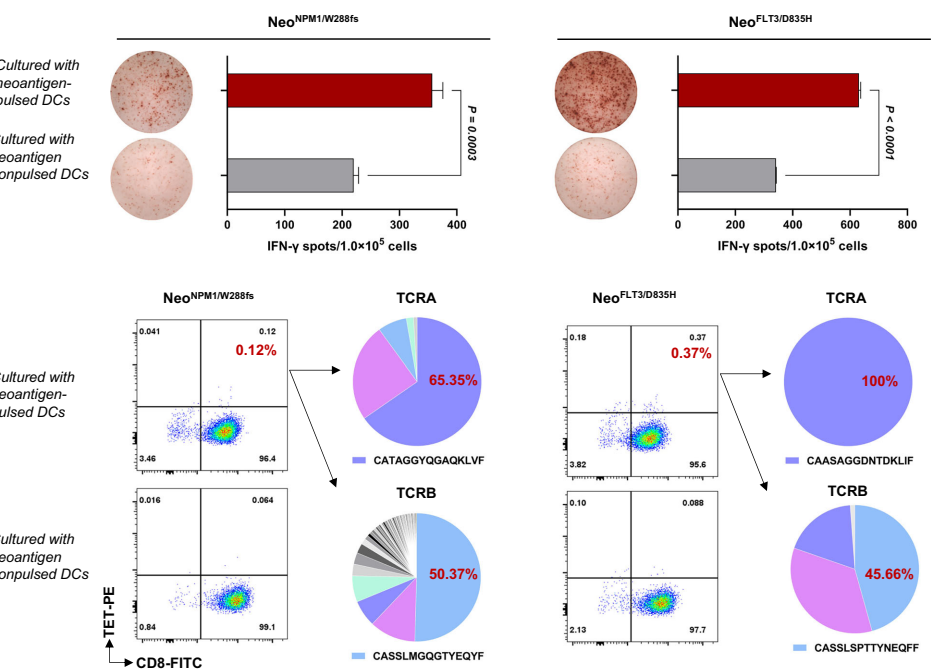
本研究针对急性髓系白血病(AML)患者因恶性髓系前体细胞基因突变积累导致的预后极差问题,开展了靶向共享新抗原的T细胞受体(TCR)工程化T细胞治疗研究。研究人员通过数据驱动方法从NPM1、FLT3等高频突变基因中筛选出HLA-A*02:01限制性新抗原,证实了NPM1/W288fs、FLT3/D835H等新抗原可诱导特异性T细胞反应,并从健康供体中成功分离出特异性TCR序列。研究证实工程化T细胞能特异性识别并杀伤内源性表达相应突变的AML细胞,为AML的过继性细胞治疗提供了新策略。

 https://hunyuan-plugin-1258344706.cos.ap-nanjing.myqcloud.com/pdf_youtu/img/06c3231f6f5c514e23b7e75baa3e390a-image.png' caption=''>
https://hunyuan-plugin-1258344706.cos.ap-nanjing.myqcloud.com/pdf_youtu/img/06c3231f6f5c514e23b7e75baa3e390a-image.png' caption=''>
 生物通微信公众号
生物通微信公众号
生物通 版权所有