编辑推荐:
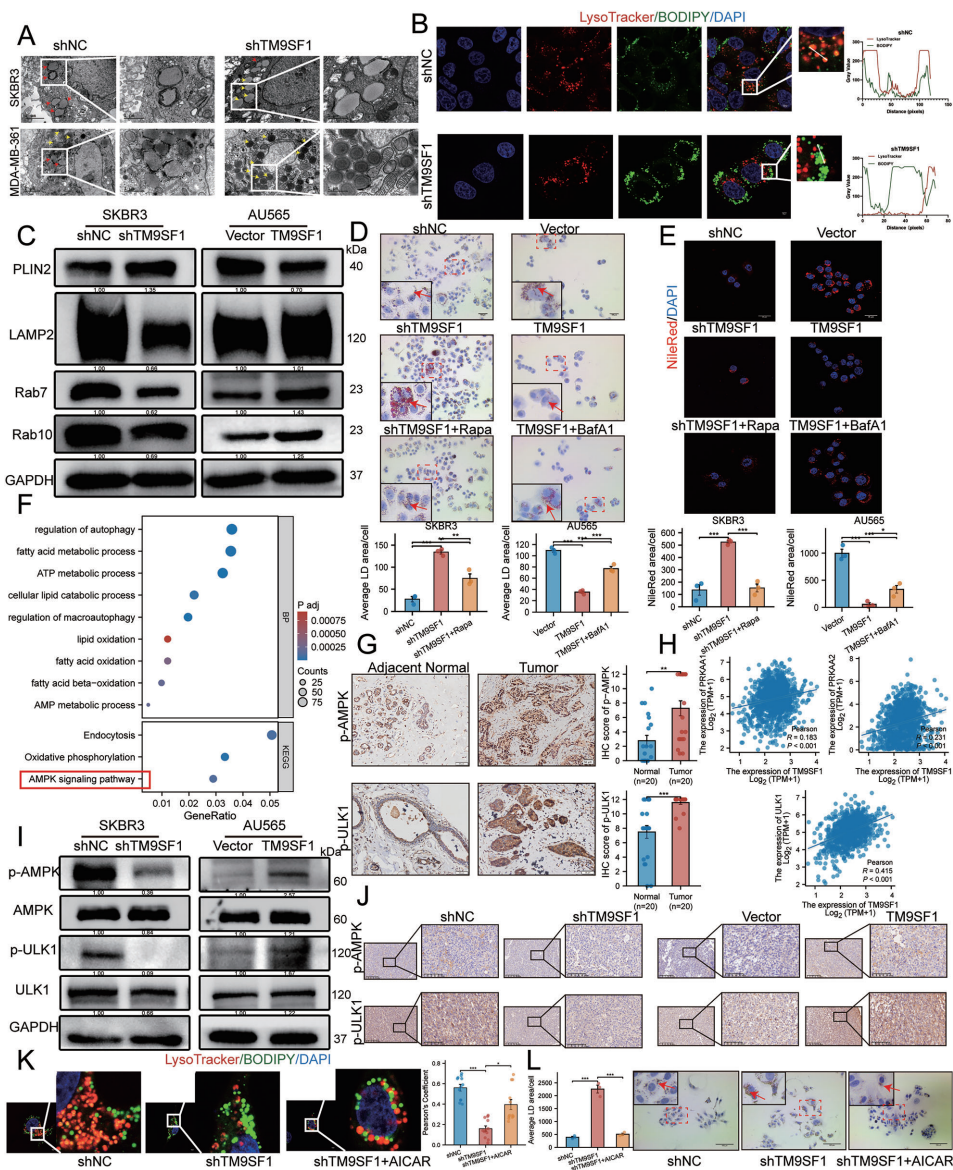
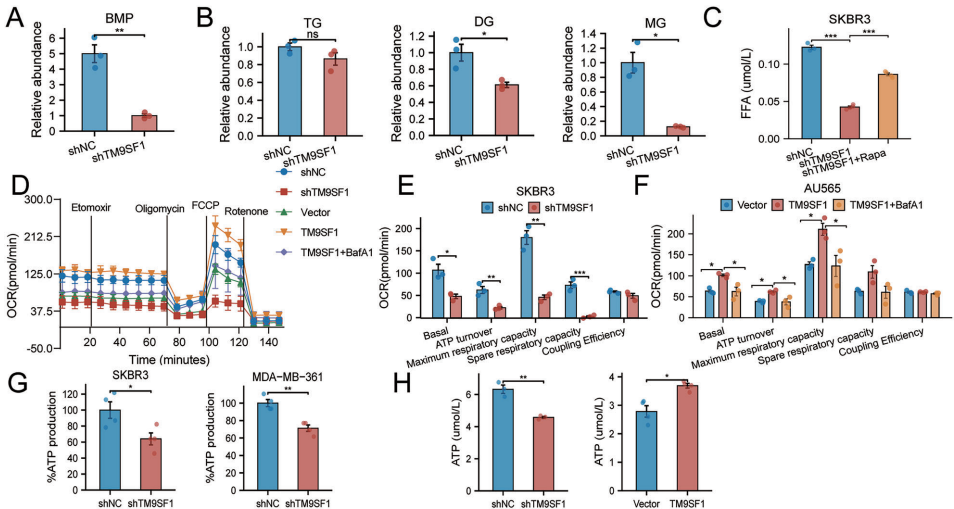
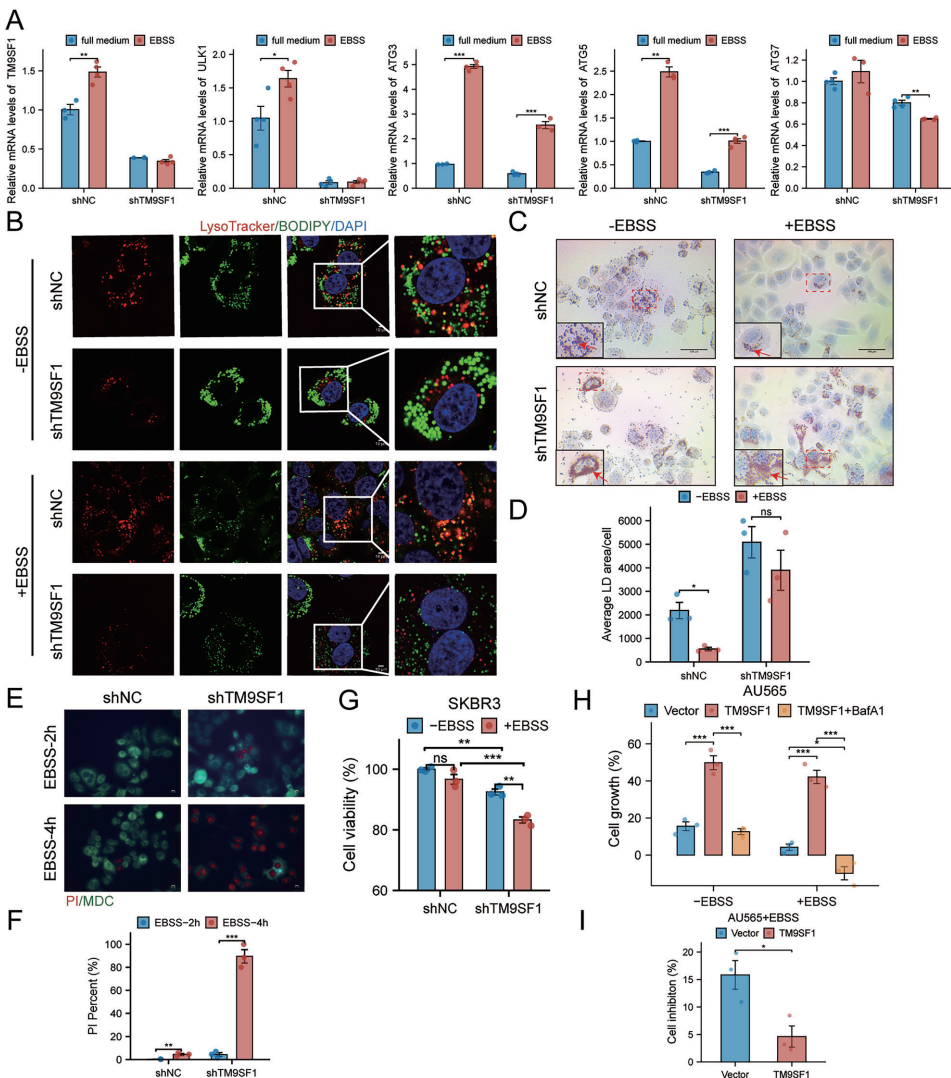
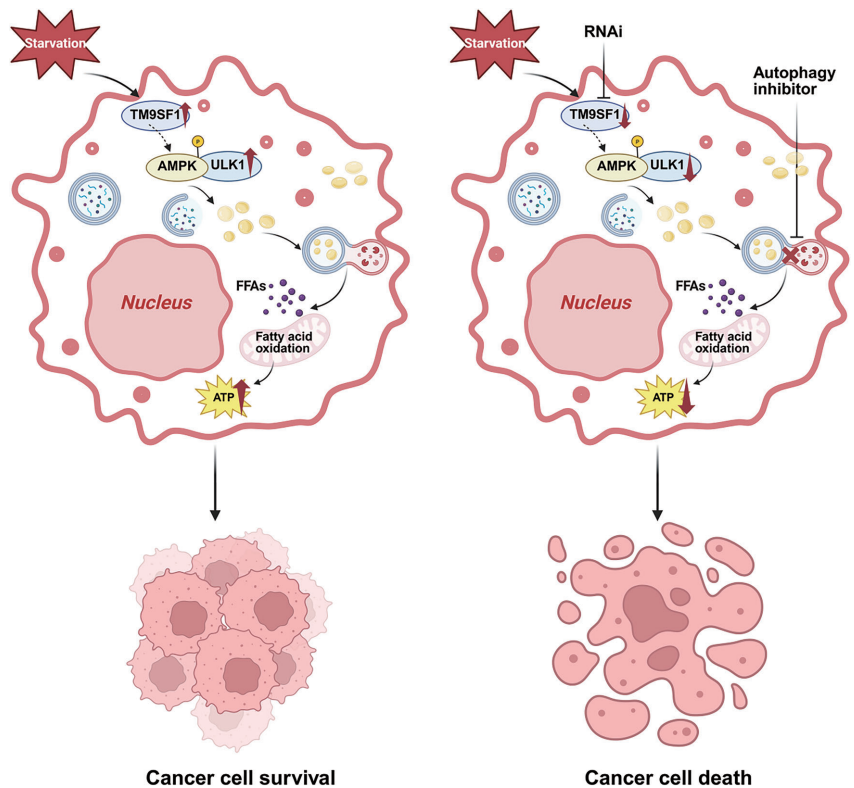
本研究针对HER2阳性乳腺癌(HER2+ BC)治疗耐药和复发难题,揭示了跨膜蛋白TM9SF1通过激活AMPK-ULK1信号通路促进脂噬(lipophagy)的关键作用。研究人员发现TM9SF1在HER2+ BC中显著上调,通过驱动脂滴(LDs)降解为游离脂肪酸(FFAs),维持细胞能量稳态,增强肿瘤对营养胁迫的适应性。该研究为克服HER2靶向治疗耐药提供了新的代谢干预靶点。
 生物通微信公众号
生物通微信公众号
生物通 版权所有