编辑推荐:
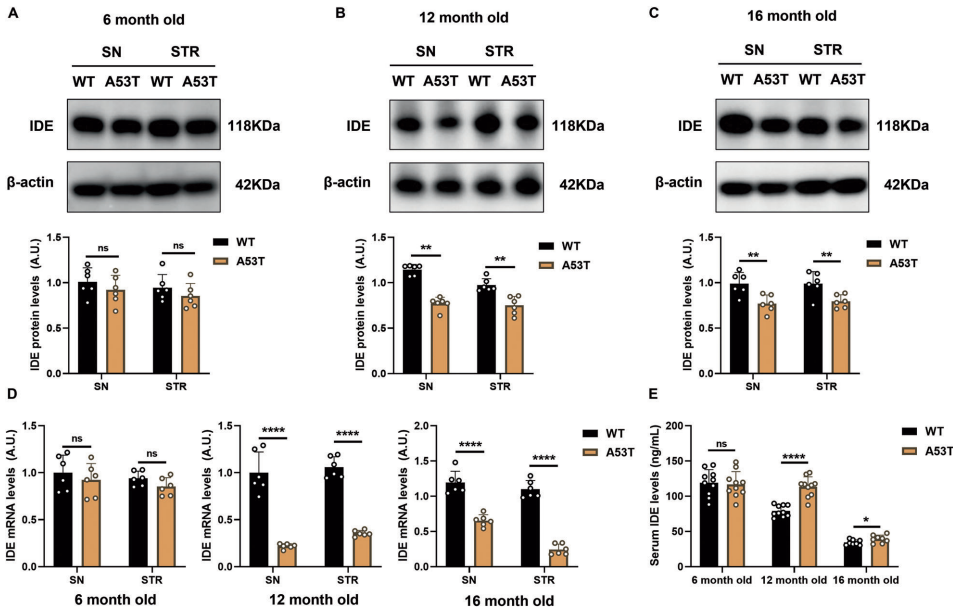
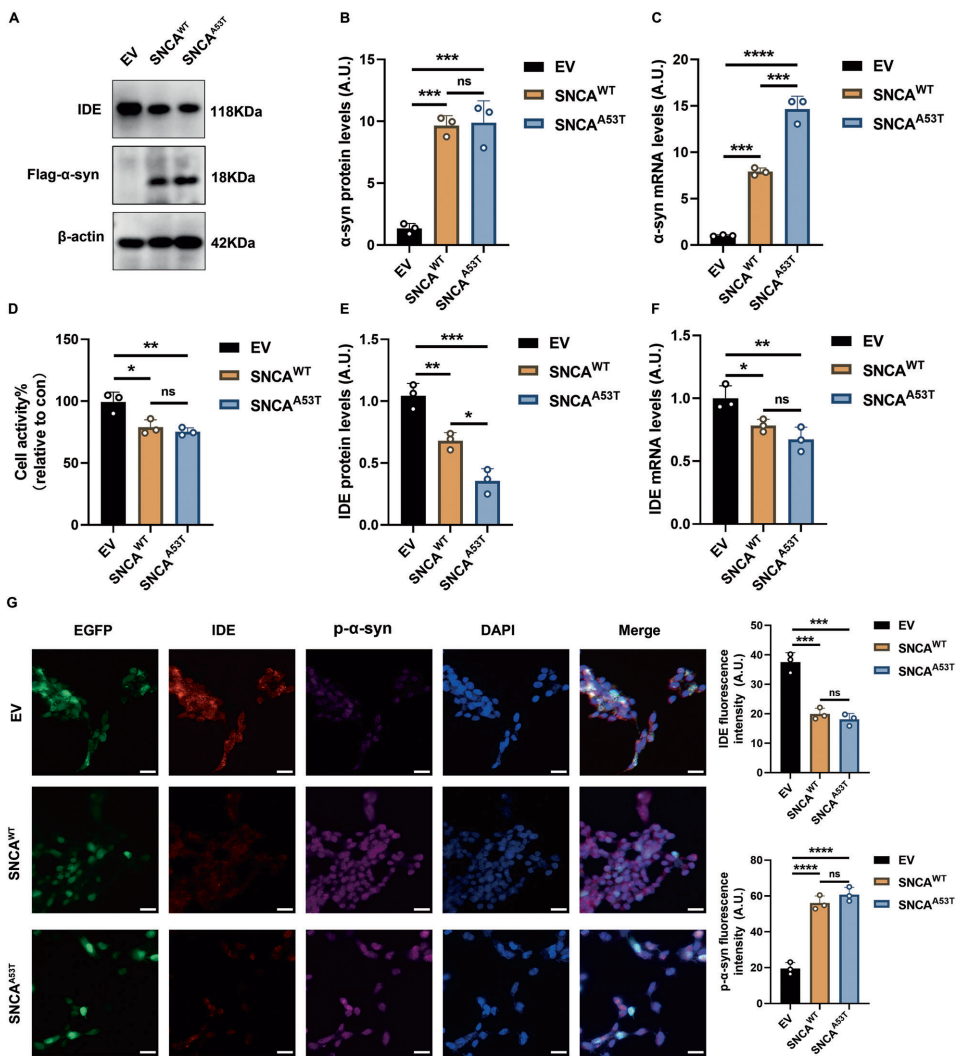
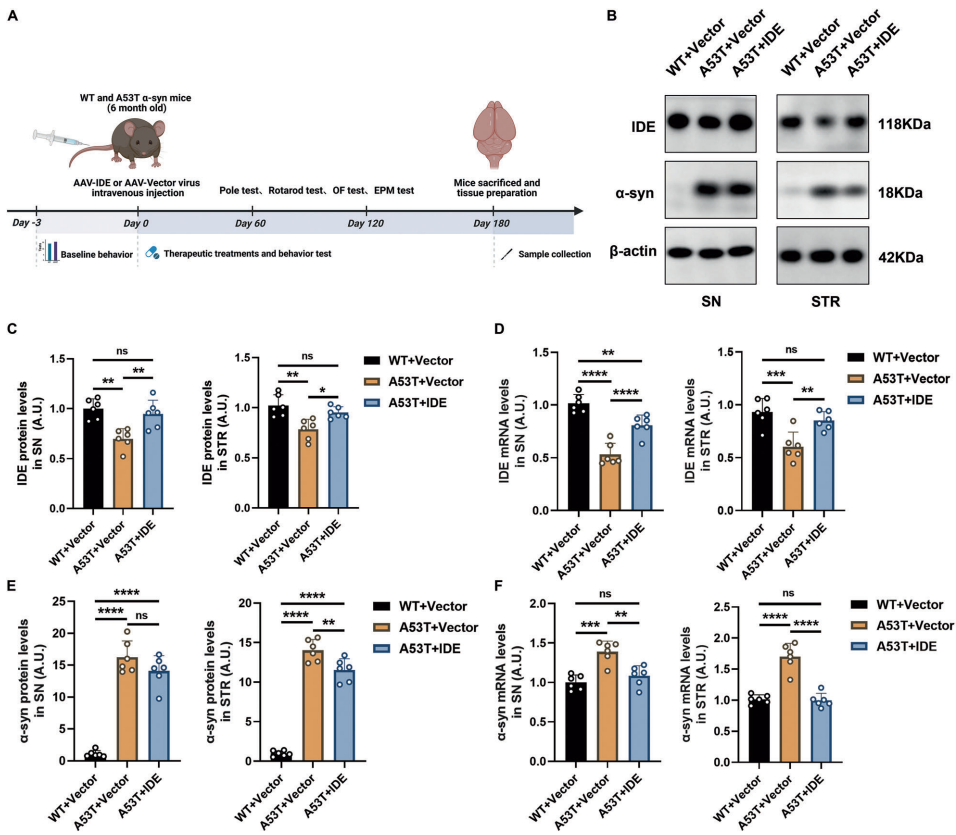
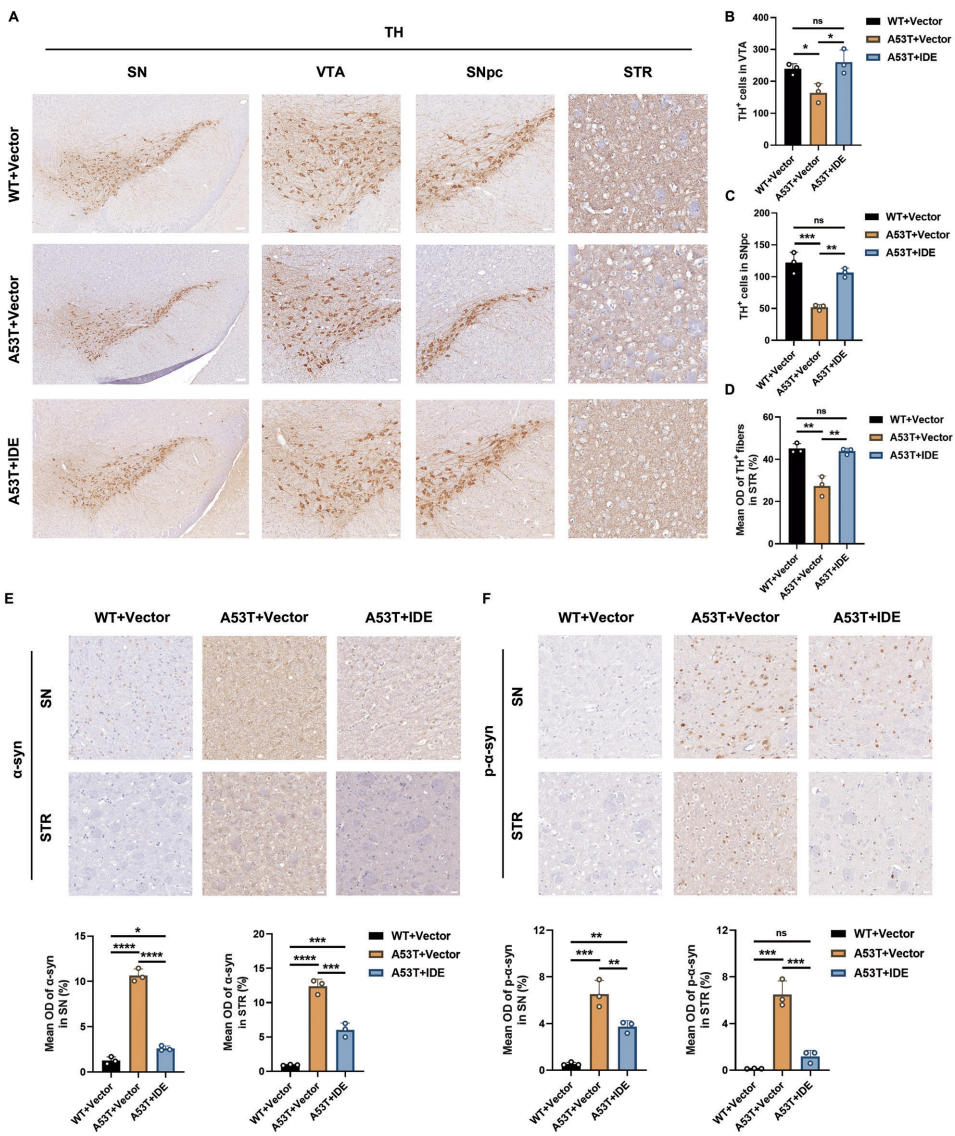
本研究针对帕金森病(PD)中α-突触核蛋白(α-syn)异常聚集的病理机制,探讨了胰岛素降解酶(IDE)的神经保护作用及分子机制。研究人员通过体内外实验发现,IDE表达下调加剧α-syn病理损伤,而过表达IDE可通过抑制Hippo信号通路核心激酶MST1/2,显著改善运动功能障碍并保护多巴胺能神经元。该研究揭示了IDE-Hippo轴在PD中的关键作用,为开发新型治疗策略提供了理论依据。
 生物通微信公众号
生物通微信公众号
生物通 版权所有