编辑推荐:
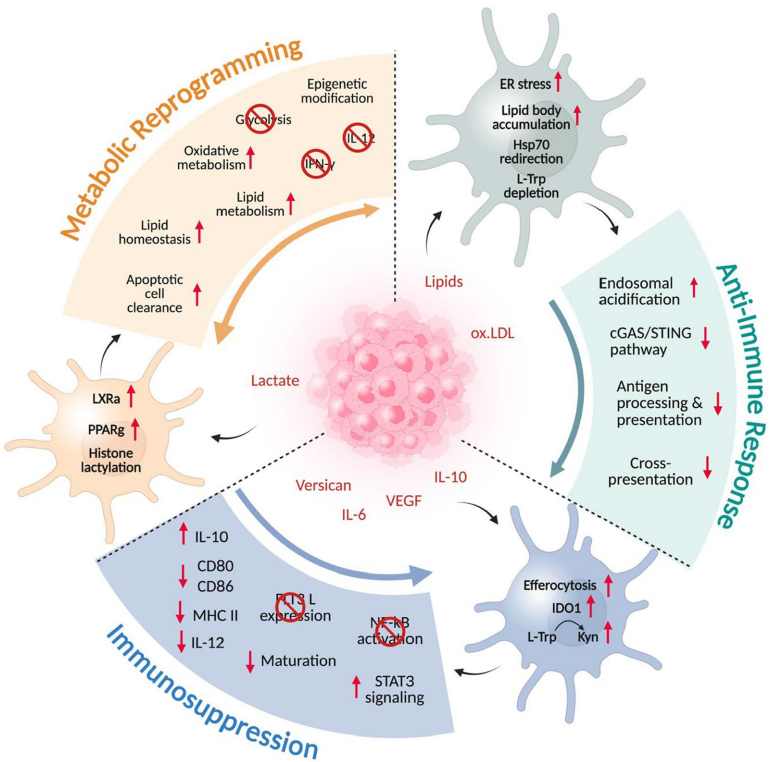
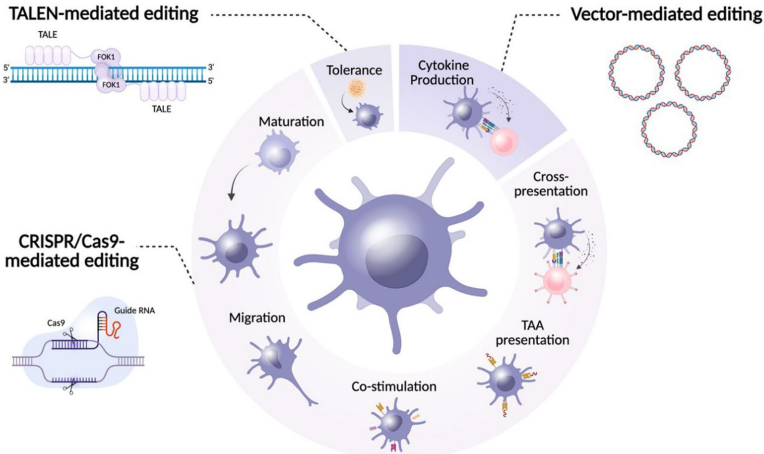
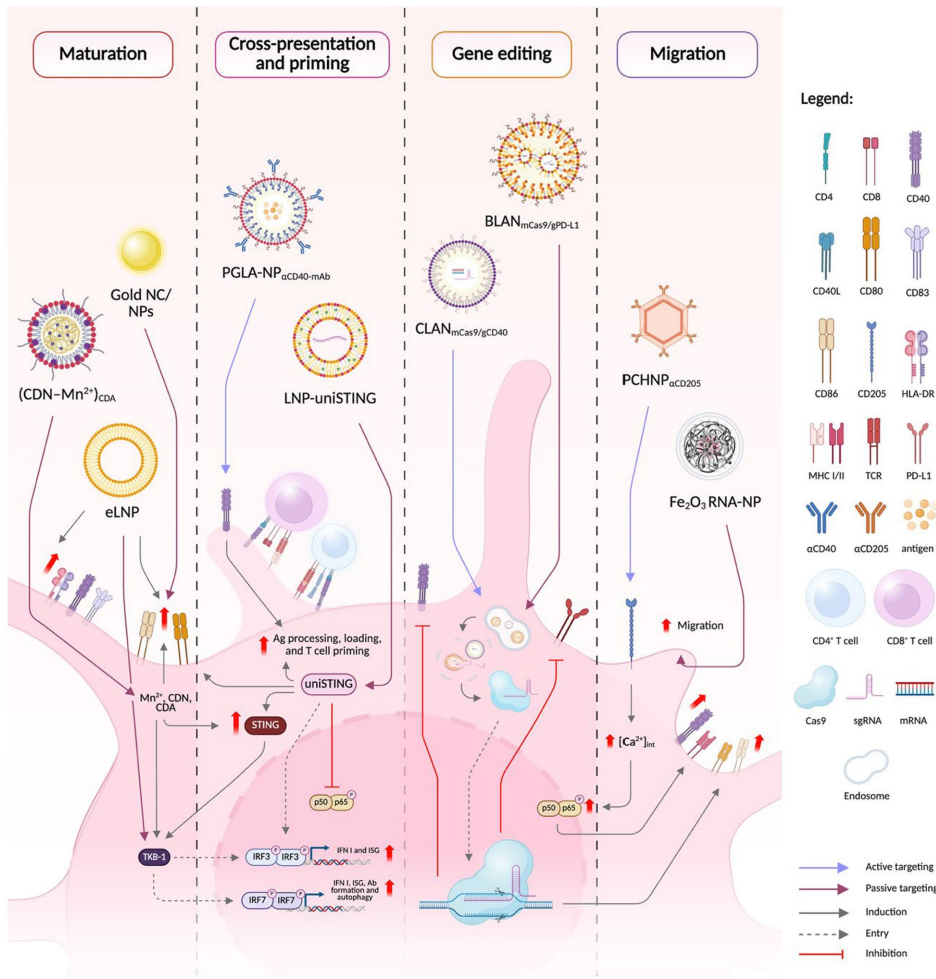
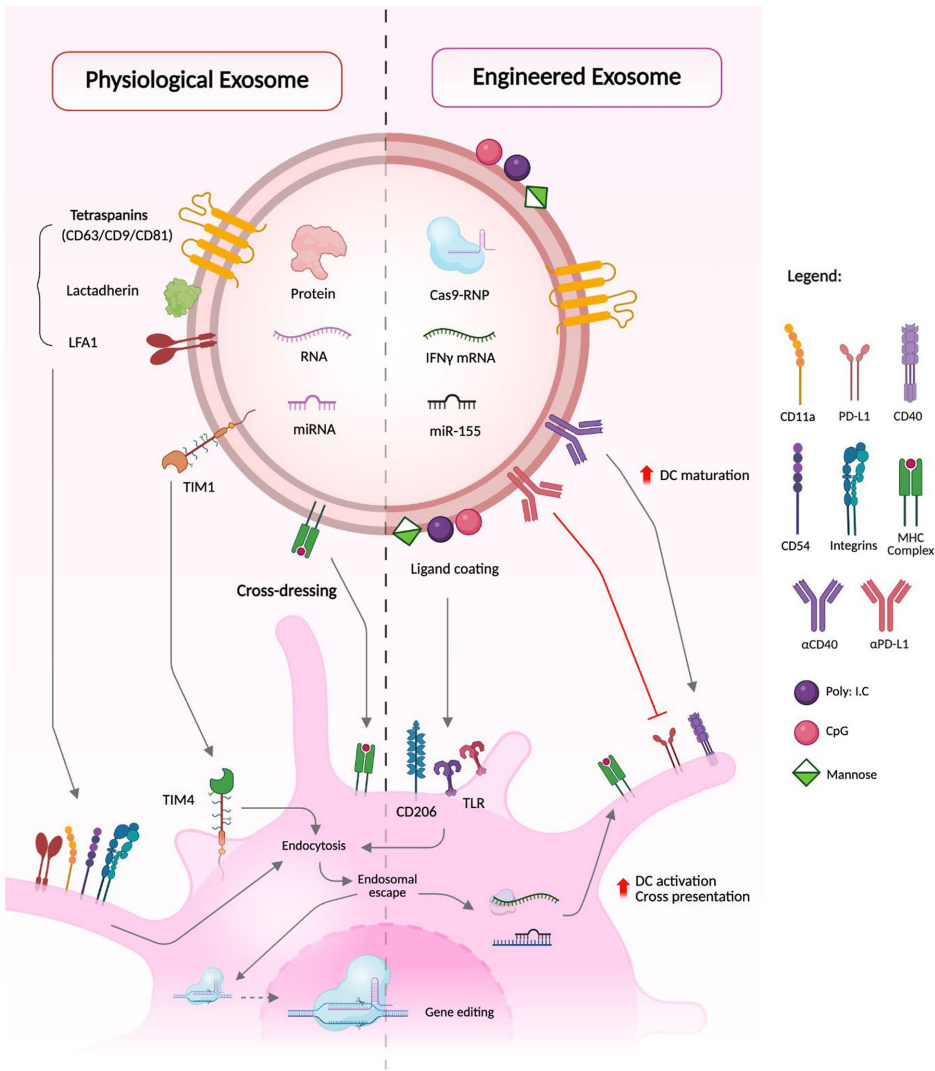
本综述系统阐述了肿瘤微环境(TME)诱导树突状细胞(DC)功能失调的机制,并重点探讨了利用CRISPR/Cas9等基因编辑技术以及脂质纳米粒(LNP)、外泌体等靶向递送系统对DC进行工程化改造的最新进展。文章强调了通过调控关键靶点(如PD-L1、CCR7、cGAS/STING通路)和采用纳米载体策略,有望克服TME的免疫抑制,从而增强DC介导的抗肿瘤免疫应答,为下一代DC疫苗的开发提供了重要方向。

 生物通微信公众号
生物通微信公众号
生物通 版权所有