编辑推荐:
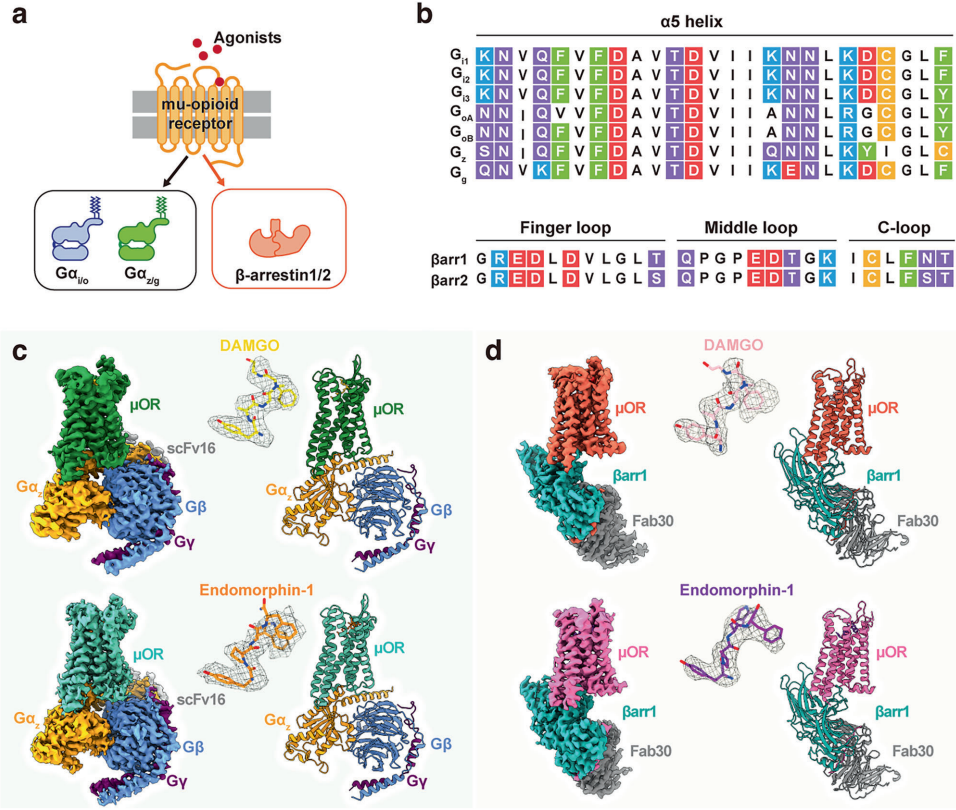
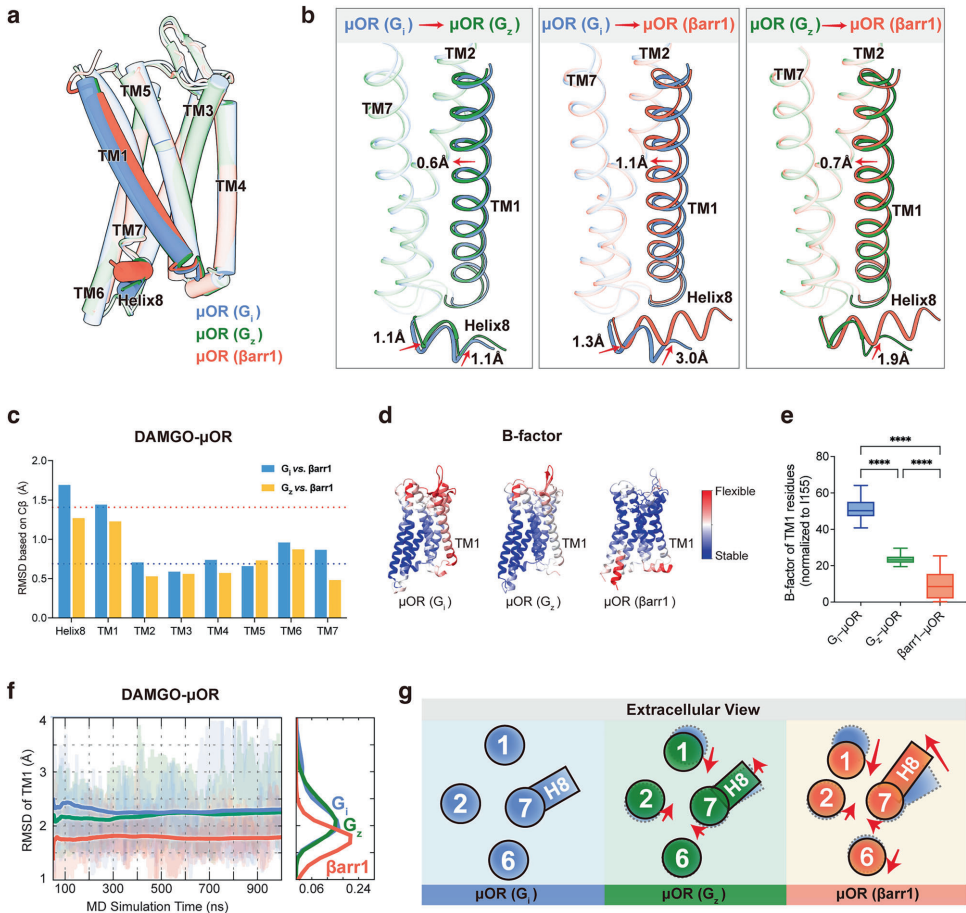
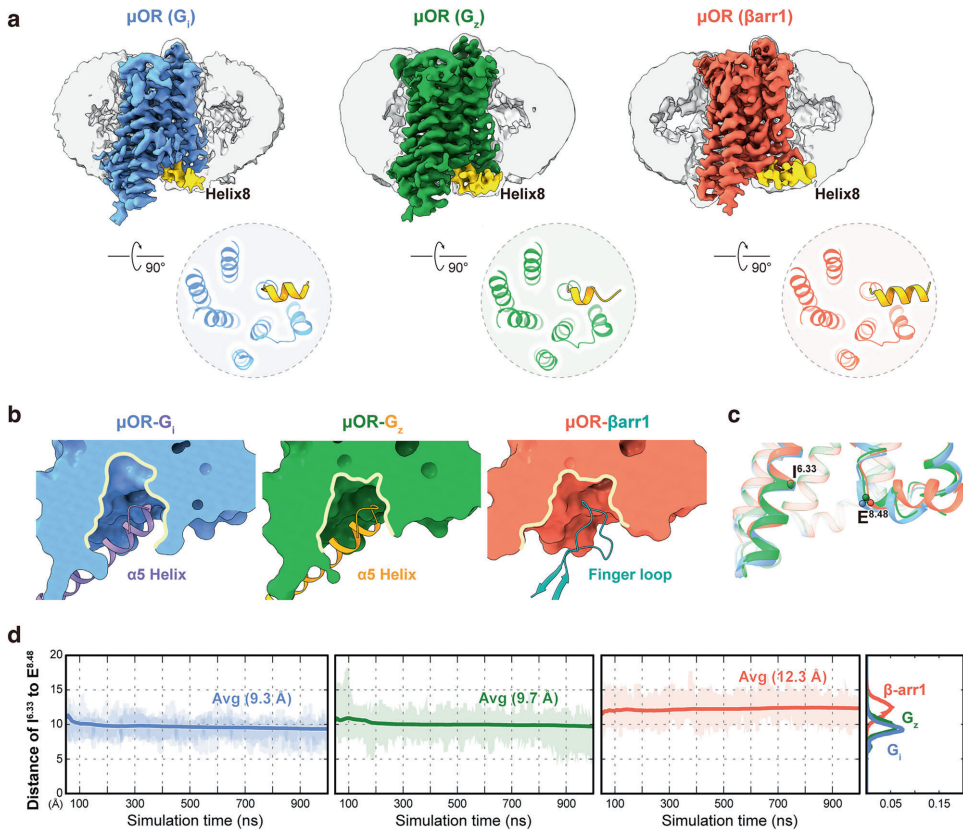
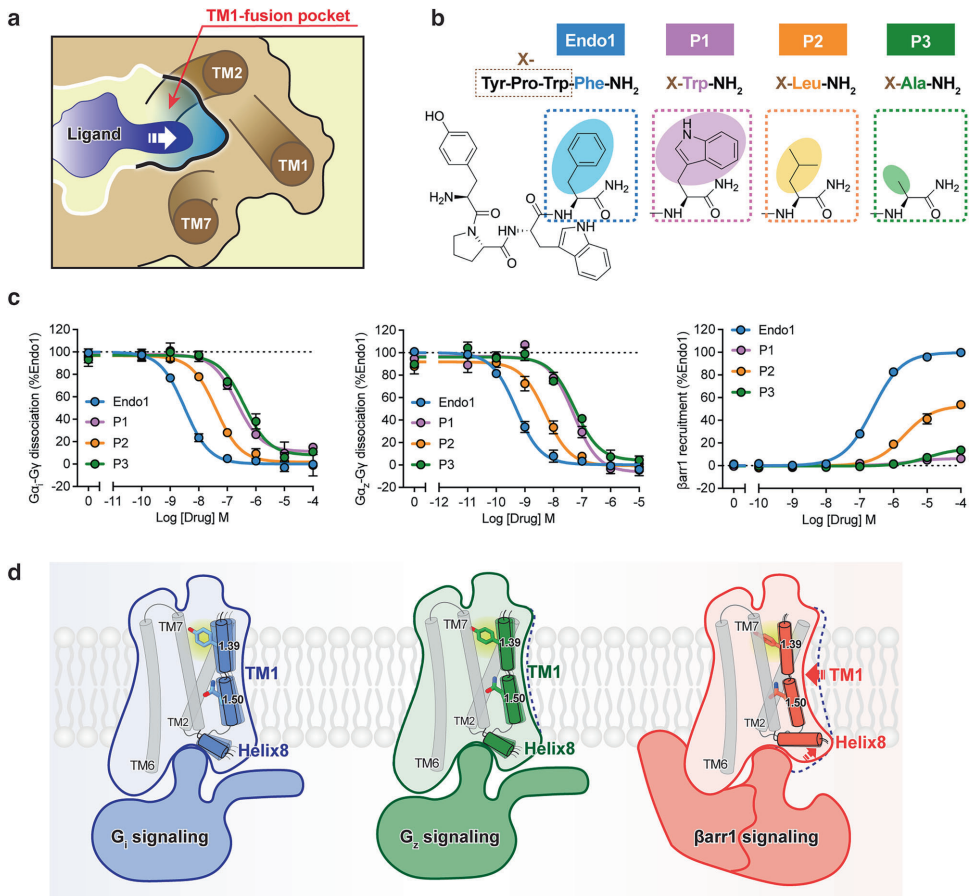
本研究针对μ-阿片受体(μOR)信号转导可塑性机制不明确的科学问题,通过解析μOR-Gz和μOR-βarr1复合物的高分辨率冷冻电镜结构,结合分子动力学模拟和突变分析,首次揭示跨膜螺旋1(TM1)通过构象异质性变构调控下游信号特异性。研究发现TM1向外位移促进G蛋白招募,向内收缩则通过稳定TM2/TM7/helix8界面增强β-抑制蛋白募集,鉴定出的TM1融合口袋为开发低副作用镇痛药提供新靶点。
 生物通微信公众号
生物通微信公众号
生物通 版权所有