编辑推荐:
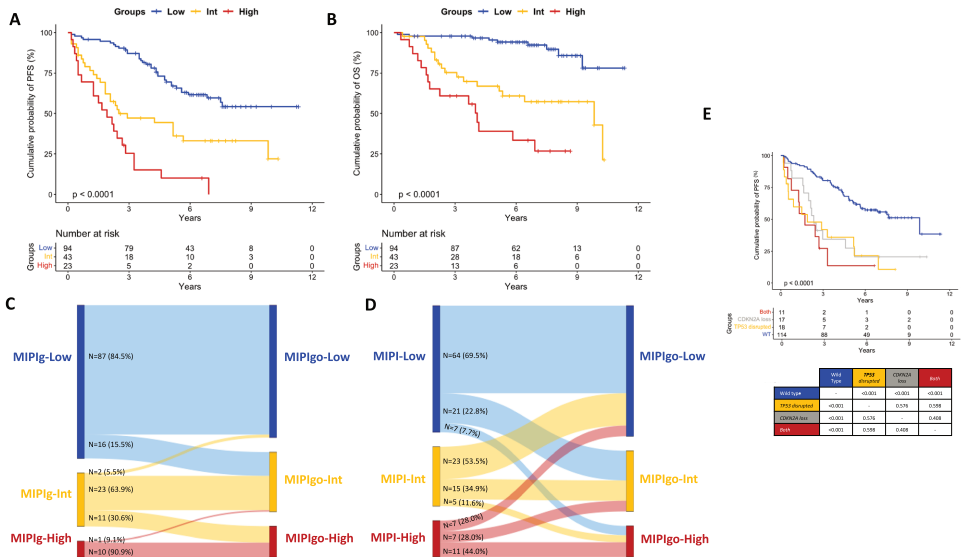
本刊推荐:为解决高危套细胞淋巴瘤(MCL)早期复发预后差的问题,研究团队通过FIL MCL0208 III期临床试验长期随访数据,整合TP53/KMT2D基因突变与CDKN2A缺失等9项拷贝数变异(CNV9+),开发出新型遗传学预后模型MIPIgo。该模型显著提升对自体干细胞移植(ASCT)后患者无进展生存期(PFS)和总生存期(OS)的预测精度,为分子分型指导的精准治疗提供新策略。
 生物通微信公众号
生物通微信公众号
生物通 版权所有