编辑推荐:
这篇综述系统阐述了生物分子相分离(LLPS)在肿瘤发生中的核心作用,揭示了其通过动态组装无膜细胞器(BMCs)调控转录激活、基因组稳定性及信号通路(如Hippo/cGAS-STING)的分子机制,并探讨了靶向相分离(如BRD4/p53/SPOP)的创新治疗策略。
生物分子相分离:肿瘤调控的新范式
Abstract
生物分子相分离(LLPS)已成为细胞内空间组织和功能区室化的核心机制,其通过多价分子相互作用形成动态凝聚体(BMCs),参与无膜细胞器组装、信号通路协调和转录程序调控。在肿瘤中,BMCs的异常行为通过改变基因调控、代谢重编程和免疫应答等过程驱动癌症特征。
结构基础与调控因素
相分离的物理化学本质源于π-π堆积、静电吸引等多价相互作用驱动的自由能降低。关键结构元件包括:
无序区域(IDRs):通过"黏附-间隔"模型介导弱相互作用,如FUS的芳香族残基突变可导致神经退行性蛋白聚集。
多结构域蛋白:如Nephrin/Nck复合物通过SH3-PRM重复模块实现信号传导的空间组织。
调控层面涵盖:
内在因素:蛋白浓度超过临界阈值时触发相变,如p53Ser392磷酸化增强其DNA结合效率。
翻译后修饰(PTMs):组蛋白乳酸化抑制cGAS相分离,促进肿瘤免疫逃逸;而USP49磷酸化增强DNA修复凝聚体形成,导致放疗抵抗。
癌症特征调控网络
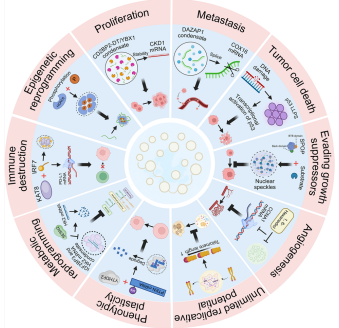
增殖与转移:FOXM1-ASPM相分离激活促癌基因;DDX21凝聚体促进结直肠癌EMT进程。
基因组稳定:RNF168的SUMO化相分离调控DNA损伤修复效率,缺陷导致染色体异常。
免疫逃逸:KAT8-IRF1相分离上调PD-L1;YTHDF3通过m6A识别降解HSPA13 mRNA增强免疫应答。
关键信号通路重塑
Hippo通路:TAZ与TEAD4的核相分离被LATS1磷酸化抑制,FBXL16通过降解LATS2促进YAP活化。
cGAS-STING:DNA触发的cGAS液滴形成被乳酸化破坏,导致先天免疫抑制。
p53通路:AARS1介导的p53乳酸化抑制其肿瘤 suppressor功能,β-丙氨酸干预可恢复活性。
治疗转化前景
临床策略呈现双向性:
促进相分离:如RQ诱导β-catenin胞质滞留抑制肝癌生长。
抑制异常凝聚:PROTAC降解BRD4破坏超级增强子(SEs),ET516溶解AR凝聚体逆转前列腺癌耐药。
挑战与展望
当前需解决相分离在体验证技术(如超分辨活细胞成像)与生理相关性(如肿瘤微环境异质性)的瓶颈。靶向BMCs的时空特异性调控将成为下一代抗癌药物开发的蓝海。
 生物通微信公众号
生物通微信公众号
生物通 版权所有