编辑推荐:
本研究揭示了组蛋白去乙酰化酶HDAC1/HDAC2通过调控E3泛素连接酶SIAH2的乙酰化稳定性,进而促进JAK2V617F突变体降解的关键机制。研究人员利用临床级HDAC抑制剂(HDACi)和基因编辑技术,证实靶向该通路可选择性清除JAK2V617F阳性肿瘤细胞,为骨髓增殖性肿瘤(MPN)提供精准治疗策略。
骨髓增殖性肿瘤(MPN)是一类以JAK2V617F突变为特征的血液系统恶性肿瘤,现有JAK抑制剂虽能缓解症状,但无法根除恶性克隆。这促使科学家将目光投向表观遗传调控因子——组蛋白去乙酰化酶(HDAC)。既往研究发现HDAC抑制剂(HDACi)对MPN患者具有显著疗效,但其分子机制始终成谜。德国美因茨大学Oliver H. Krämer团队在《Signal Transduction and Targeted Therapy》发表的研究,首次揭示了HDAC1/HDAC2通过乙酰化修饰调控SIAH2稳定性,进而触发JAK2V617F降解的精确分子开关,为开发选择性靶向疗法提供了理论依据。
研究团队运用多学科技术手段:①采用临床级HDACi(FK228、MERCK60)处理原代MPN细胞和细胞系;②通过CRISPR-Cas9构建SIAH2基因敲除模型;③结合免疫共沉淀和质谱分析解析蛋白互作网络;④利用TCGA数据库进行临床预后关联分析;⑤建立JAK2V617F小鼠移植瘤模型评估体内疗效。
【HDAC1/HDAC2控制JAK2V617F-STAT信号】
实验显示,选择性抑制HDAC1/HDAC2可显著诱导MPN细胞凋亡,并伴随JAK2V617F蛋白水平下降。通过siRNA敲低和抑制剂MERCK60验证,证实这两种HDAC亚型对维持恶性细胞生存具有不可替代的作用。
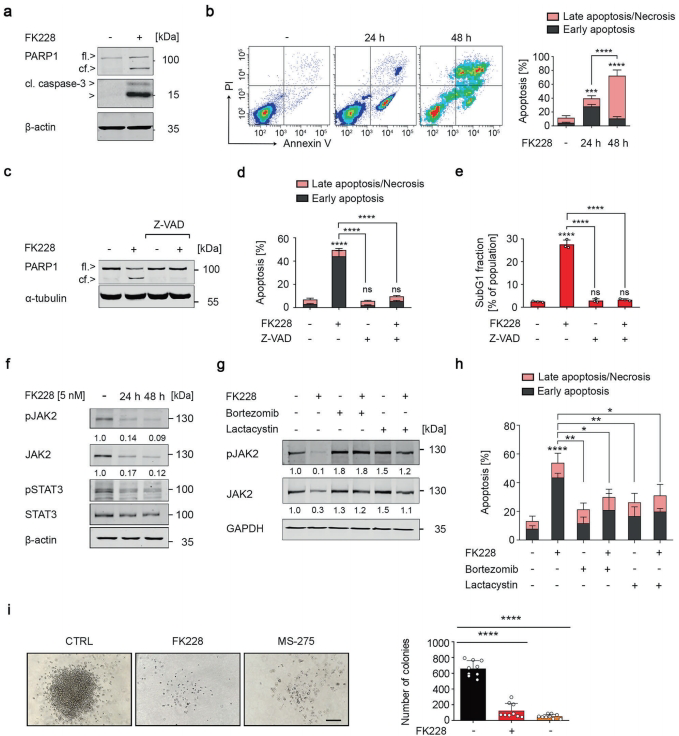
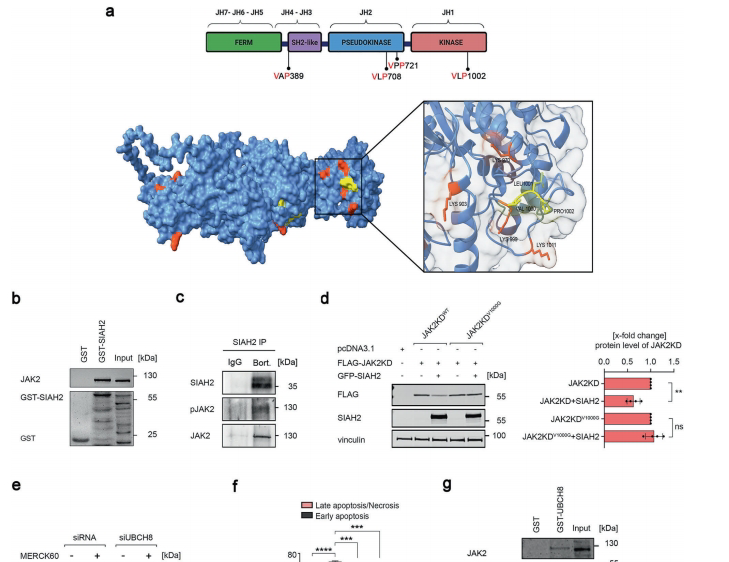
【SIAH2介导的降解机制】
研究发现HDACi通过增加SIAH2第139位赖氨酸乙酰化(ac-K139)延长其半衰期。SIAH2作为E3泛素连接酶,识别JAK2激酶结构域中的VLP1002降解信号,协同E2泛素结合酶UBCH8促进JAK2V617F多聚泛素化。基因敲除实验证实SIAH2缺失会完全阻断HDACi的治疗效果。
【治疗安全性与转化价值】
值得注意的是,HDAC1/HDAC2抑制剂对正常造血干细胞毒性较低。动物实验显示,经MERCK60预处理的JAK2V617F细胞移植后,其外周血嵌合率显著降低(p<0.01)。临床数据分析进一步揭示,HDAC1高表达与急性髓系白血病(AML)患者不良预后显著相关(p=0.02)。
这项研究不仅阐明了HDACi治疗MPN的分子基础,更发现SIAH2-JAK2V617F互作界面可作为药物设计新靶点。研究者特别指出,相比广谱HDACi,选择性靶向HDAC1/HDAC2的抑制剂(如MERCK60)具有更佳的治疗窗口,为开发下一代表观遗传疗法指明了方向。该成果同时揭示了细胞核内表观调控因子通过修饰胞质蛋白影响信号转导的全新模式,为癌症治疗提供了新的研究范式。
 生物通微信公众号
生物通微信公众号
生物通 版权所有