编辑推荐:
本刊推荐:为解决CAR-T细胞治疗后反应不耐久及免疫治疗序列疗效递减的难题,研究人员开展针对BCMA靶点CAR-T细胞治疗多发性骨髓瘤的免疫微环境共进化研究。通过单细胞多组学技术发现CAR-T治疗显著重塑内源性T细胞格局,鉴定出新型过渡性CD8+ T细胞群体可预测不良预后,并揭示TIM3/GAL9互作介导的免疫抑制机制。该研究为优化T细胞免疫疗法提供了新型生物标志物和治疗靶点。
在血液肿瘤治疗领域,免疫疗法尤其是嵌合抗原受体T细胞(CAR-T)疗法带来了革命性突破,但在多发性骨髓瘤(MM)治疗中仍面临严峻挑战——尽管多数患者初期对BCMA靶向CAR-T治疗产生反应,这些反应往往缺乏持久性,且后续免疫治疗线的效果呈现递减趋势。这种"免疫续航力"下降的现象背后,隐藏着CAR-T细胞与免疫微环境之间复杂的动态相互作用机制,而这一关键问题尚未被系统阐明。
近日发表于《Leukemia》的研究通过单细胞多组学技术深入解析了CAR-T治疗对免疫微环境的重塑作用。研究人员通过对24例接受ide-cel(bb2121)BCMA CAR-T治疗的多发性骨髓瘤患者进行纵向采样,整合单细胞转录组测序(scRNA-seq)、CITE-seq(细胞表位转录组联合测序)和VDJ测序技术,系统描绘了CAR-T细胞与内源性T细胞的共进化图谱。样本来源包括KarMMa-2(NCT03601078)和KarMMa-3(NCT03651128)临床试验的骨髓与外周血样本,采集时间点覆盖治疗前(筛查期)、治疗后1个月(M2D1)和6个月(M7D1)。
研究结果揭示多个重要发现:
CAR-T细胞治疗重塑功能性T细胞生态系统
通过Smart-Seq2和10x Genomics平台对3491个CD8+ T细胞的分析显示,CAR-T细胞呈现高度分化状态,表达显著升高的耗竭标志物(如HAVCR2/TIM3)和激活特征。与内源性T细胞相比,CAR-T细胞几乎全部为CD8+亚型,且循环细胞比例更低, naïve样细胞几乎缺失。
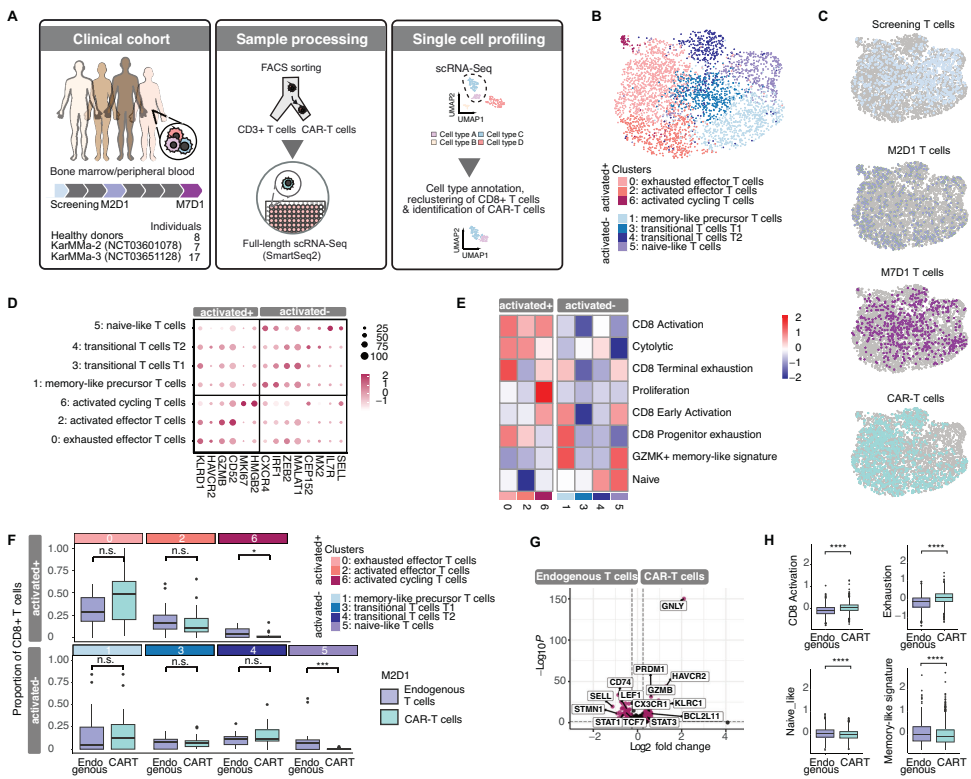
CAR-T治疗患者CD8+ T细胞区室中的竞争性分化状态
研究发现内源性CD8+ T细胞的激活在M2D1时达到峰值但到M7D1时回归基线,而naïve样T细胞持续耗竭。过渡性T细胞亚群(T1和T2)呈现动态变化:T1先降后升,T2持续增加。这些过渡细胞状态表达低水平的激活、耗竭和naïve标志物,代表中间状态。
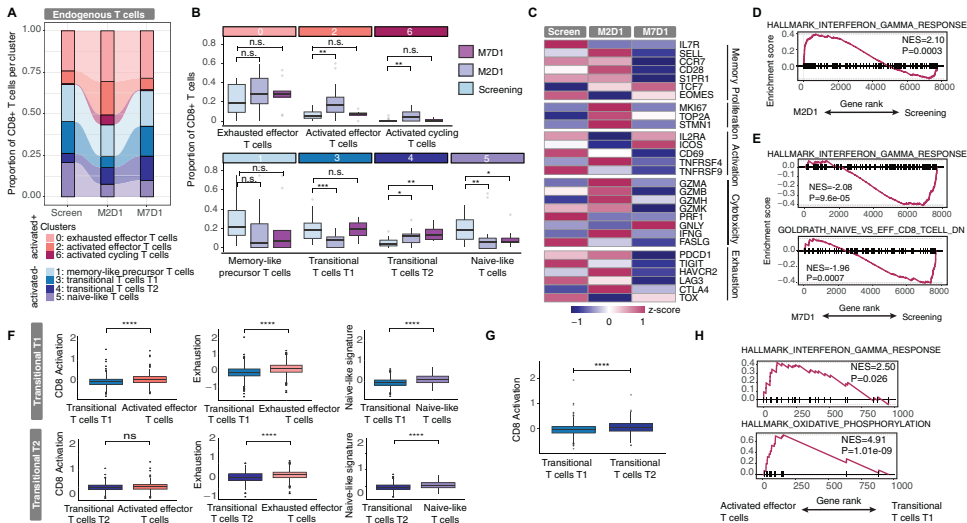
CAR-T细胞状态与临床反应的关联
按无进展生存期(PFS)将患者分为长期应答者(LTR)和短期应答者(STR)后发现,STR的CAR-T细胞高表达耗竭(PD-1、TIM3、TIGIT)和凋亡标志物,而LTR则显示记忆相关基因高表达。CAR-T细胞持久性与低耗竭水平显著相关。
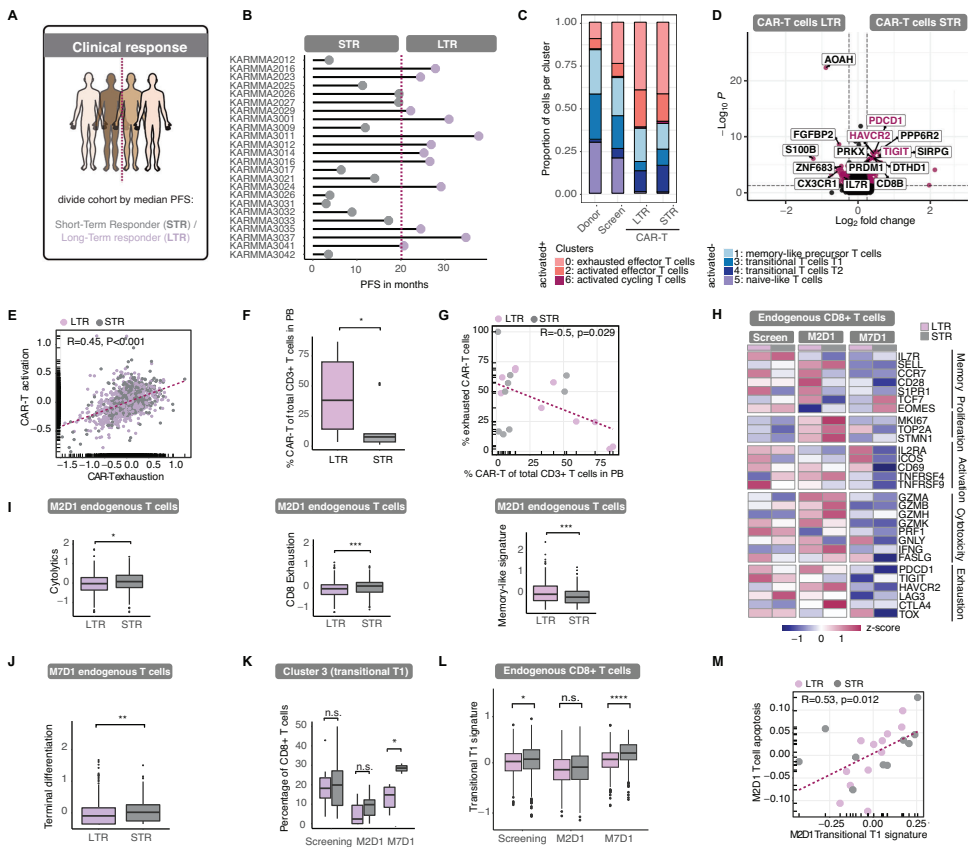
内源性免疫力预测CAR-T细胞治疗后的抗肿瘤免疫反应
研究发现筛查期预先存在的T细胞状态不能预测治疗反应,但M2D1时内源性T细胞区室出现显著差异:STR表现出更高的细胞溶解和耗竭标志物表达,而LTR显示增强的记忆样特征。特别值得注意的是,过渡性T1状态与不良反应相关,其信号在筛查期即已升高并可预测不良临床结果。
CAR-T细胞治疗后骨髓免疫微环境的持续性组成变化
对4例患者骨髓样本的液滴式单细胞测序分析显示,CAR-T治疗初期使骨髓组成向髓系/单核细胞区室倾斜,而CD8+效应细胞先降后升。TCR克隆性分析表明,39%的克隆型在筛查期和M7D1时共存,且共享克隆型的平均大小显著增加。RNA速度分析揭示了从naïve样状态通过记忆样和过渡亚群(T1和T2)或通过部分激活细胞向激活效应状态发展的分化轨迹。
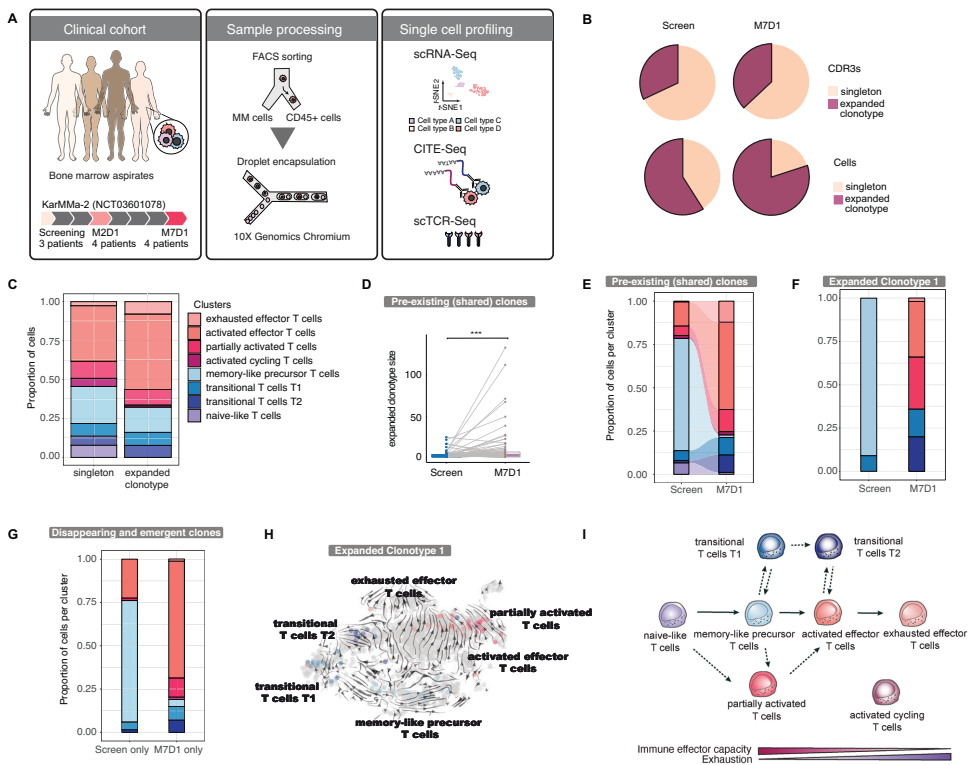
GAL9作为细胞间相互作用的介质促进免疫抑制性T细胞微环境
研究鉴定出TIM3(在CAR-T细胞上高表达)与其配体GAL9之间的相互作用是关键免疫抑制机制。血清GAL9水平与CAR-T细胞持久性基因表达呈负相关。体外实验证实GAL9处理可降低CAR-T和未转导T细胞的活力,而GAL9阻断抗体可部分恢复活力。
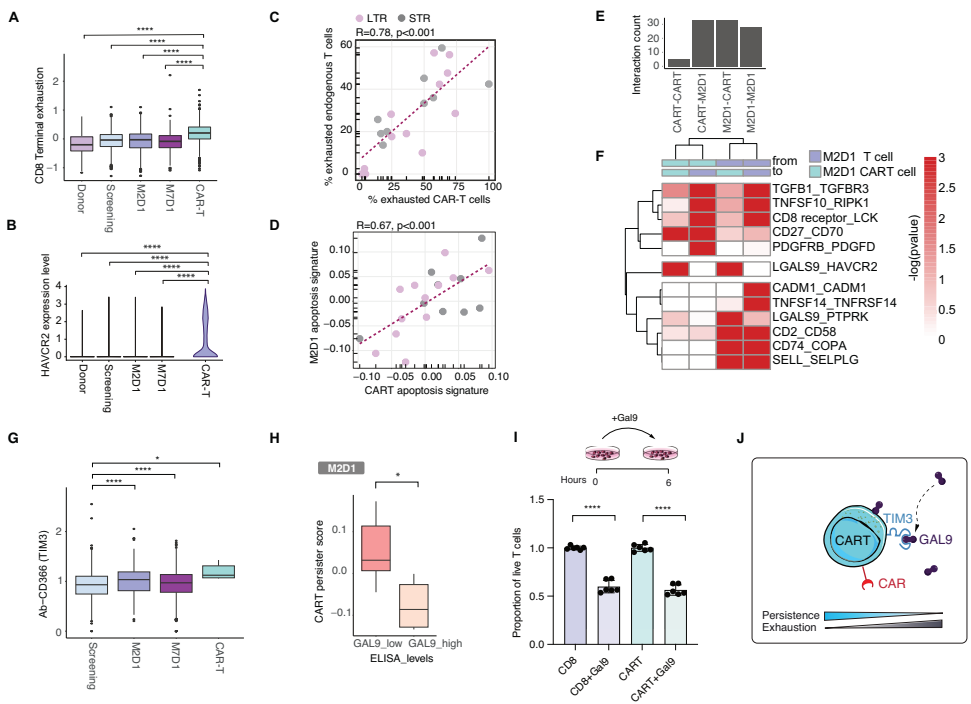
研究结论与讨论部分指出,CAR-T细胞治疗在驱动内源性T细胞沿分化路径发展的同时,最终可能导致终末耗竭和耗竭,这解释了为何即使针对不同抗原的CAR-T细胞多次给药也效果递减。发现的过渡性T细胞群体可作为预测免疫治疗反应的生物标志物,而TIM3/GAL9相互作用则是调节免疫能力的关键机制,具有增强CAR-T细胞持久性的治疗潜力。这些发现为临床决策提供信息,并有助于开发更有效的免疫疗法。研究局限性包括患者和细胞数量较少、ide-cel特异性以及淋巴清除与CAR-T治疗效应的不可分割性,但为未来研究提供了重要框架。
 生物通微信公众号
生物通微信公众号
生物通 版权所有