编辑推荐:
本研究针对急性髓系白血病(AML)年龄分层治疗的临床现状,通过分析2823例来自美国和德国的成人AML患者分子数据,发现基因突变和细胞遗传学异常呈年龄相关连续分布,且总体生存期(OS)随年龄增长几乎线性下降(P<0.001),即使在ELN 2022风险分组中仍存在显著年龄差异。结果表明基于固定年龄切点的治疗策略缺乏分子生物学依据,为临床试验资格和药物审批提供了年龄灵活性依据。
急性髓系白血病(AML)是一种主要影响老年患者的血液系统恶性肿瘤,但其发病年龄跨度极大,从青年到老年均可发生。长期以来,临床实践中常将患者简单划分为"年轻"和"老年"两组,并基于此决定治疗方案。这种划分主要基于观察到的老年AML患者预后较差的现象,以及假定老年患者体能状态下降和合并症增加的观念。然而,随着对AML分子生物学理解的深入和靶向治疗的发展,单纯依靠年龄进行治疗方案选择的合理性正受到挑战。
目前美国食品药品监督管理局(FDA)甚至将年龄限制写入某些靶向药物的标签说明中,这可能导致部分年轻患者无法获得有效的靶向治疗。同时,不同临床试验采用不同的年龄切点(如39岁、55岁或60岁),使得研究结果难以比较和解释。这些年龄切点是否具有分子生物学依据?年龄是否应该成为临床试验入排的主要标准?这些问题成为AML研究领域亟待解决的重要问题。
为了解决这些问题,由Monica Cusan和Karilyn Larkin共同第一作者,Tobias Herold和Ann-Kathrin Eisfeld共同通讯作者领导的研究团队开展了一项跨大洲的多维度研究。该研究分析了来自美国和德国的两个大型协作组——癌症和白血病组B(CALGB/Alliance)和AML协作组(AMLCG)的2823例成人AML患者数据,这些患者均接受了基于阿糖胞苷的强化诱导治疗,并通过靶向测序平台进行了分子特征分析。研究成果发表在《Leukemia》杂志上,为AML的年龄分层治疗提供了新的证据。
研究采用了几项关键技术方法:收集了1986-2017年间2823例初治AML(非急性早幼粒细胞白血病)患者的临床数据,这些患者来自美国和德国的多个医疗中心;通过靶向测序平台检测了24个共享的AML相关基因突变,使用≥2%的变异等位基因频率(VAF)作为 cutoff值;采用细胞遗传学分析预处理骨髓/血液样本,并经中心核型审查确认;使用Kaplan-Meier法计算总生存期(OS),Cox比例风险模型估计风险比(HR),统计分析由Alliance统计与数据管理中心完成。
研究结果
临床特征分析
研究共纳入2823例成人AML患者,中位年龄55岁(范围18-92岁),45%为女性。按2022年欧洲白血病网(ELN)遗传风险分组,34%属于 favorable风险组,27%为 intermediate风险组,39%为 adverse风险组。79%的患者诊断时体能状态较好(ECOG 0-1),26%的患者在第一次完全缓解(CR)时接受了异基因造血干细胞移植(HSCT)。
AML相关基因突变随年龄的变化模式
研究人员分析了从18岁到75岁以上成年AML患者的遗传改变,发现了三种不同的年龄相关频率模式:
第一组包括非线性年龄频率分布的改变,涉及最常见的AML相关基因突变,如NPM1、DNMT3A基因突变和FLT3内部串联重复(FLT3-ITD)、FLT3酪氨酸激酶结构域突变(FLT3-TKD)、NRAS和EZH2突变,以及影响黏连蛋白复合体基因(RAD21、SMC1A、SMC3、SF3B1、STAG2)的突变。
第二组由频率随年龄增长而增加的遗传改变组成,包括ASXL1、BCOR、IDH1、IDH2、RUNX1、SRSF2、TET2和TP53基因突变,以及复杂核型和正常核型。
第三组包括频率随年龄增长而降低的改变,如CEBPA、GATA2、KIT、KRAS、PTPN11和WT1基因突变,以及核心结合因子平衡重排[即t(8;21)(q22;q22)和inv(16)(p13.1q22)/t(16;16)(p13.1;q22)]和涉及11q23带和KMT2A(原MLL)基因的重排。

这些模式在美德两个队列中惊人地相似,且未能识别出一致的特定年龄切点来界定遗传改变模式的明显变化。此前定义的功能组也显示了类似情况。
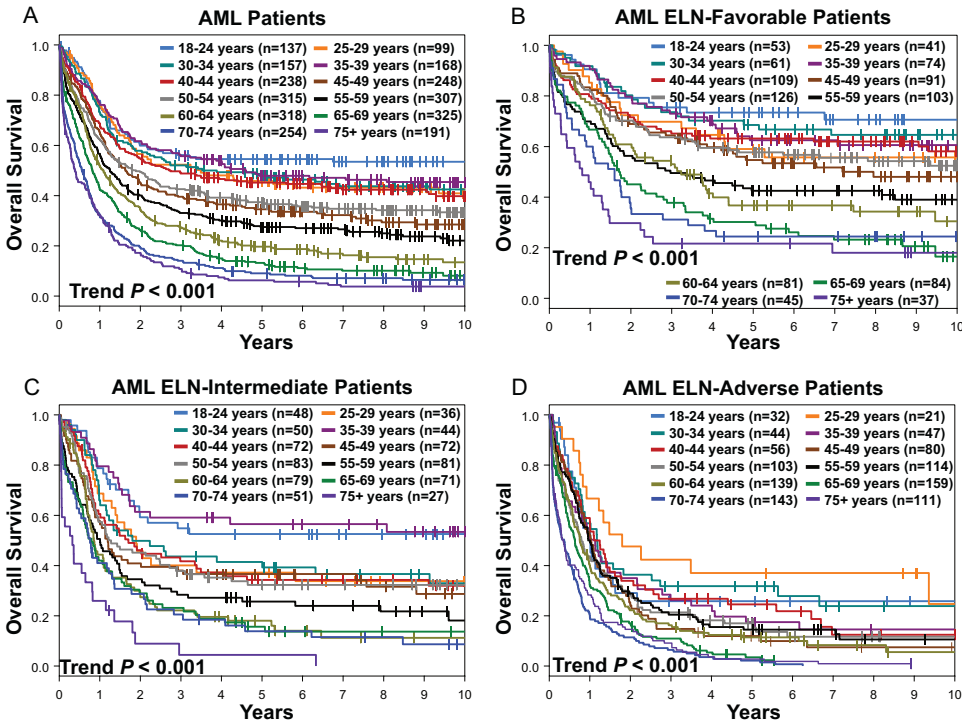
OS随年龄增长而减少
所有患者的5年OS率为40%,OS缩短与年龄增加呈正相关。这种年龄相关的OS恶化在2022 ELN遗传风险组中一致存在。
在2022 ELN favorable遗传风险患者中,估计5年存活率从75岁及以上患者的21%到最年轻患者(18-24岁)的73%不等。2022 ELN intermediate遗传风险患者也遵循这种生存模式,≥75岁患者的5年OS率为4%,而18-24岁患者为53%。在2022 ELN adverse遗传风险患者中,变异性较小,70-74岁患者的最低5年OS率为2%,而25-29岁患者的最高5年OS率为37%。
关于年龄区间内的CR和ED率,观察到CR率随年龄增长而降低的趋势,ED率随年龄增长而增加的趋势,但同样没有明确的年龄依赖性分界点。
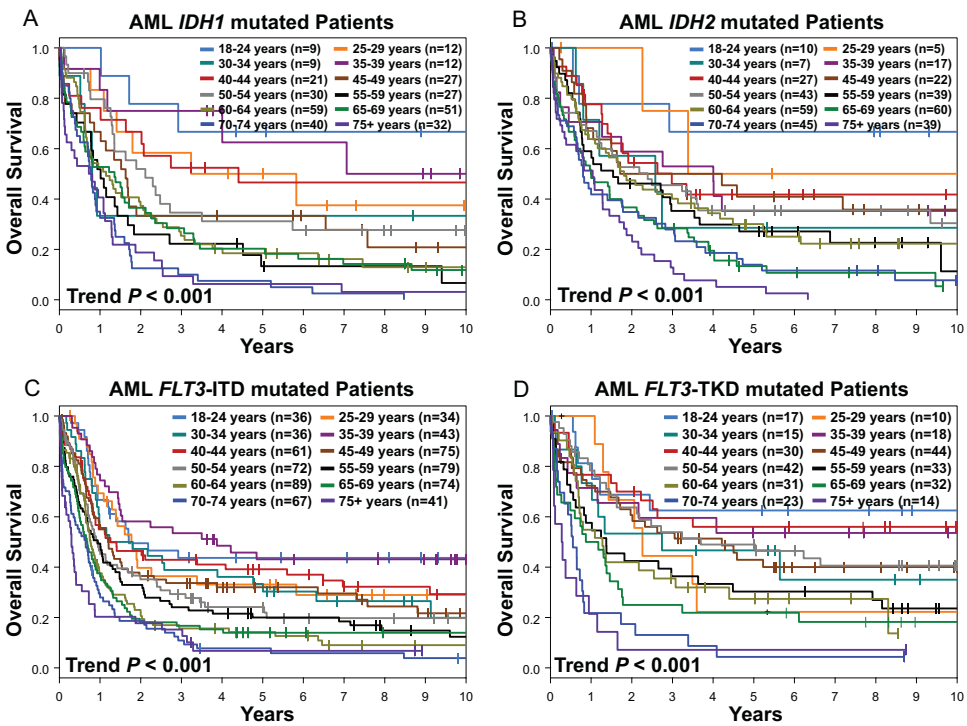
年龄依赖性结局在突变亚组中的变化
研究人员评估了年龄对携带特定复发AML相关基因突变患者结局的影响,重点关注已有获批靶向抑制剂的突变,包括IDH1和IDH2基因突变、FLT3-ITD和FLT3-TKD。
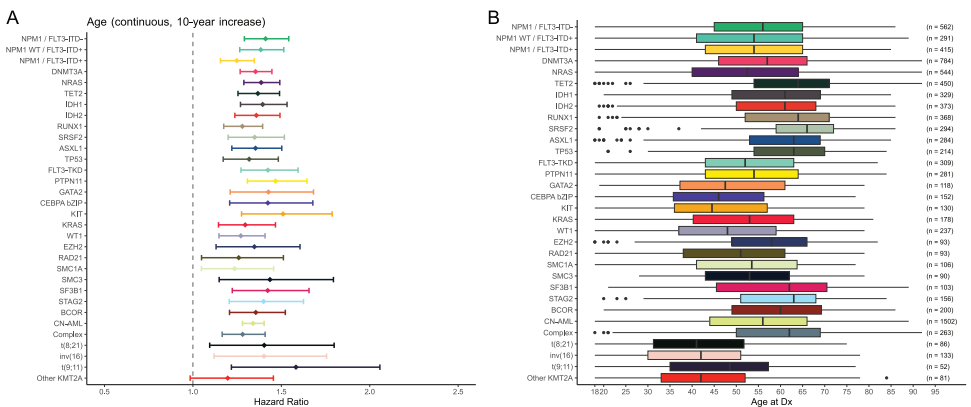
在这些分子定义的亚组中,发现年龄实际上在IDH1和IDH2突变组以及FLT3-ITD和FLT3-TKD中都有负面的预后影响。为了进一步研究年龄对个体突变结局的相关性,将年龄作为连续变量计算了突变亚组中年龄的风险比。
分析显示,年龄增加与所有预后相关的AML相关基因突变和染色体重排的生存较差显著相关,除了涉及11q23/KMT2A而非t(9;11)(p22;q23)的重排。每个突变患者的中位年龄与年龄对死亡风险影响的大小无关。
研究结论与讨论
本研究首次大规模跨洲描绘了包含整个成年年龄谱的AML突变模式和结局。研究人员描述了不同的年龄相关分子分布模式,这些模式不支持单一年龄的分子生物学基础来证明年轻与年老的年龄分类。
虽然本研究试图挑战 chronological年龄在AML中的相关性,但实际上表明年龄在已按2022 ELN分类的患者中提供了进一步的风险分层,且几乎呈连续方式,属于同一2022 ELN遗传风险组的最年轻和最年长患者之间的OS存在实质性差异。年龄相关生存 adverse风险组中不太明显,这并不奇怪,因为该组患者的总体结局较差,表明 adverse风险疾病特征的权重超过了年龄相关因素的重要性。
当检查预后相关的AML相关基因突变和复发染色体异常关于年龄的预后影响时,发现大多数这些改变的既定负面生存关联随着年龄增长而恶化。同样,一些与良好结局相关的遗传异常,如无FLT3-ITD的NPM1突变和inv(16),也倾向于随着患者年龄增长而失去其有利影响。相比之下,除t(9;11)外的11q23/KMT2A重排的不良预后影响与年龄无关,但由于样本量相对较小,需要额外验证。
这项研究仅限于符合临床试验资格要求的患者,这意味着具有更严重器官功能障碍、不受控制的感染和并发恶性肿瘤的真实世界患者子集未包括在内。此外,由于西班牙裔或黑人患者的样本量相对较小,在考虑我们的发现可能与这些患者群体相关的程度时应谨慎,并强调了所有未来试验设计和注册中多样性和包容性考虑的重要性。
总之,选择精确的年龄切点(如39岁用于区分青少年和年轻成人患者与老年人,或59岁用于识别"年轻"和"年老"AML患者)似乎不受我们分析结果的支持。虽然我们的意图是评估定义的年龄切点是否得到遗传改变模式的支持,但我们的数据倾向于反驳任何统一切点在年龄谱中的存在,无论是考虑18-39岁的年轻成人人群,还是以55岁或60岁以上定义老年AML患者的"年轻和年老"区分。
先前的报告已经描述了年龄相关的突变频率差异,但这些观察结果仅限于仅两个预定义年龄组之间的比较,如<60岁与≥60岁,或儿童/青少年与成人。在本研究中,我们确实使用5年间隔分析了年龄,这使我们能够观察不同突变的不同年龄模式。使用年龄作为二分化变量用于治疗决策或临床试验入组的缺点也得到了若干报告的支持,这些报告揭示了临床试验与"真实"世界数据之间的强烈年龄差异。
过去几年已经看到了特定AML亚群中生物学驱动因素转化为抑制剂靶点的令人兴奋的转化,这些抑制剂在复发和难治性疾病中展示了单药活性,以及与标准疗法联合使用时增加了生存期。希望未来,接受这些靶向治疗且随访时间更长的患者数量将足够增加,以便能够执行类似于我们在此报告的研究,包括分析年龄对2022 ELN遗传风险组内患者结局的影响,以及携带特定预后相关驱动突变和/或细胞遗传学异常的患者。这将确定我们的结论是否适用于与我们研究的患者群体不同的治疗人群,即仅接受强化化疗的患者。此外,基于年龄、突变谱和体能状态的集成算法可能会被开发出来,有助于做出个体化治疗决策。加上所有临床试验采用的增加开放性,这将给所有患者机会获得针对其个体特征的最佳可用治疗。
 生物通微信公众号
生物通微信公众号
生物通 版权所有