编辑推荐:
为解决高危骨髓增生异常肿瘤(hr-MDS)和急性髓系白血病(AML)患者对阿扎胞苷+维奈托克(aza/ven)联合治疗的耐药问题,研究人员通过整合纵向基因测序、蛋白质组学和BH3凋亡功能分析,发现BCL-2高依赖性患者治疗反应更佳,而BCL-xL/MCL-1依赖性升高导致耐药。该研究为个体化治疗策略提供了重要依据。
在血液系统恶性肿瘤领域,高危骨髓增生异常肿瘤(high-risk Myelodysplastic Neoplasms, hr-MDS)和急性髓系白血病(Acute Myeloid Leukemia, AML)的治疗始终充满挑战。尽管去甲基化药物(Hypomethylating Agents, HMA)如阿扎胞苷(azacitidine, aza)与BCL-2抑制剂维奈托克(venetoclax, ven)的联合方案显著改善了部分患者的预后,但原发性耐药和高复发率仍然是临床实践中的主要障碍。这种治疗困境的背后,是白血病细胞通过复杂的克隆演变和凋亡逃逸机制实现的生存优势。为了深入解析这些机制,一个研究团队开展了系统性研究,通过多组学整合分析揭示了治疗过程中动态变化的遗传背景和功能依赖性特征,相关成果发表在血液学顶级期刊《Leukemia》上。
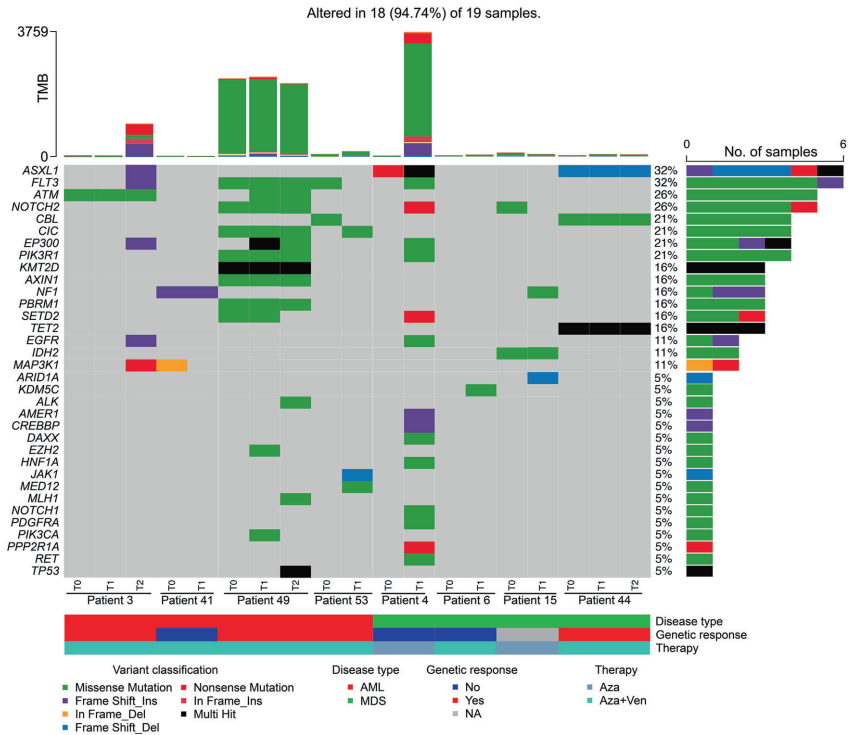
研究团队建立了包含55例患者的单中心纵向样本库,收集了268个时间点(平均每人8.7个)的样本,综合运用细胞遗传学、靶向测序(53基因 panel)、全外显子测序(Whole-Exome Sequencing, WES)、蛋白质组质谱分析和流式细胞BH3凋亡分析等功能实验,重点探索了治疗响应与抵抗的分子与功能标志。队列中包括23例MDS和32例AML患者,中位年龄72岁,多数接受阿扎胞苷单药或联合维奈托克治疗。
研究发现,基线遗传特征呈现典型高危变异,如del(5q)、RUNX1、TET2突变等。纵向遗传分析显示,治疗过程中出现NRAS、KRAS、TP53等高危突变,以及16q-、17p-等染色体异常,提示克隆演变是疾病进展和耐药的重要驱动。此外,蛋白质组学分析显示,MDS/AML细胞相比健康供体,氧化磷酸化(OXPHOS)通路下调、糖酵解通路上调,体现了肿瘤细胞的代谢重编程。
研究最突出的发现来自于BH3凋亡分析(BH3 profiling)。该功能实验通过测定线粒体细胞色素c释放程度,评估细胞对不同BCL-2家族抗凋亡蛋白(如BCL-2、BCL-xL、MCL-1、BFL1)的依赖性。在治疗起始时,高BCL-2依赖性(通过BAD-HRK差值评估)与良好的遗传学反应(克隆大小或变异等位基因频率下降≥50%或10%)和更长的总生存期(14个月 vs 4.5个月,p=0.038)显著相关。相反,高BCL-xL依赖性与原发性耐药相关。

纵向动态分析进一步揭示了获得性耐药机制:在疾病进展时,不仅常见克隆扩张,还伴随凋亡 priming 下降和抗凋亡依赖性的转换——例如部分病例从BCL-2依赖转变为BCL-xL或MCL-1依赖。这些功能变化可能由新发突变(如NRAS)或表型适应引起,与药物压力相关。
细胞系实验(MDS-L、Kasumi-1、EOL-1、OCI-AML3)验证了上述发现:动态BH3分析显示,维奈托克或联合用药可上调BCL-xL依赖性;而BCL-xL抑制剂A1331852能有效增强阿扎胞苷+维奈托克的细胞毒性。MCL-1抑制剂AZD5991也显示出类似的增敏效果,提示多靶点抑制可能是克服耐药的策略。
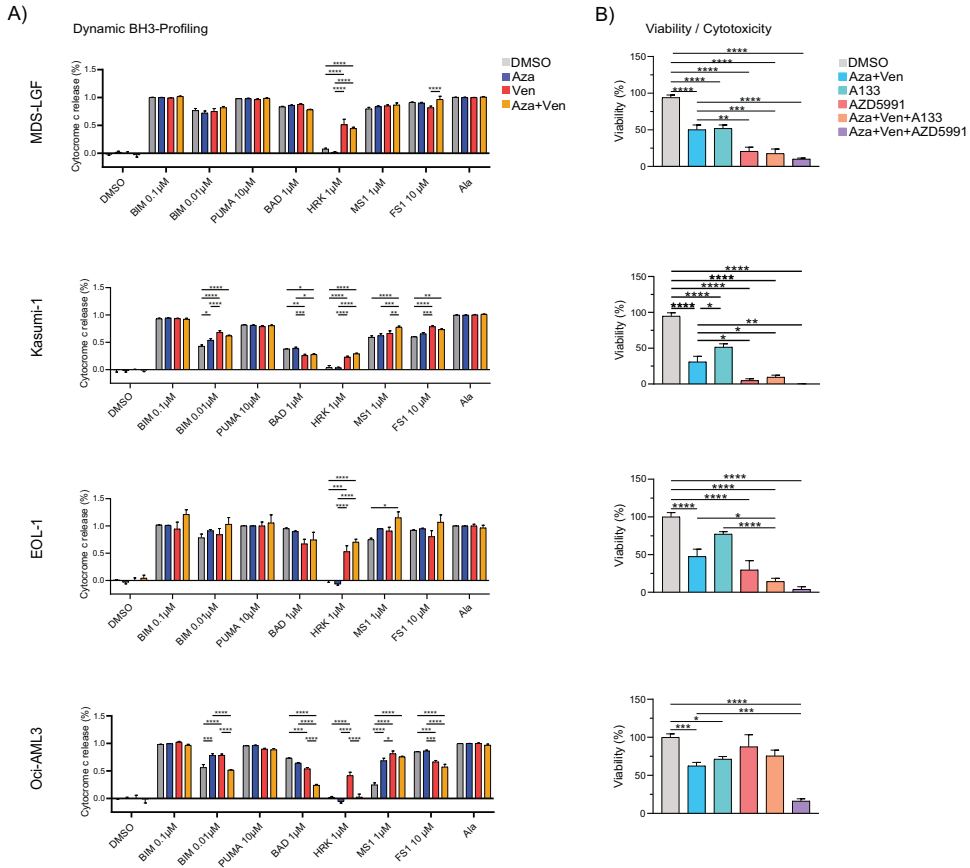
该研究强调,BH3凋亡分析是一种强有力的功能生物标志物工具,能够捕捉到遗传分析未能揭示的凋亡调控状态变化。它不仅可预测维奈托克疗效,还能动态监测耐药的出现,为临床决策提供依据。例如,对于BCL-xL或MCL-1依赖性上升的患者,可考虑联合相应靶向药物,如BCL-xL降解剂DT2216或正处于临床开发阶段的MCL-1抑制剂。
研究的局限包括样本量有限、部分遗传变异未经验证,蛋白质组学分析也未实现响应者/非响应者间的分层。然而,这项整合研究首次在MDS/AML纵向治疗背景下,同步追踪遗传演变与功能凋亡状态,为理解治疗抵抗提供了多维度视角,也为开发个体化、序贯式靶向治疗策略奠定了坚实基础。
 生物通微信公众号
生物通微信公众号
生物通 版权所有