编辑推荐:
本研究针对社区获得性肺炎(CAP)患者呼吸道菌群失调与宿主免疫互作的科学问题,通过纵向多组学分析揭示了Streptococcus oralis(SOR)在流感防御中的关键作用。团队发现SOR能激活IL-17F等先天免疫通路,通过及时启动/消退炎症反应显著降低小鼠肺部病毒载量(降低48h PFU 1.5 log),其保护效果媲美益生菌LGG。该成果发表于《Signal Transduction and Targeted Therapy》,为呼吸道微生态调控提供新靶点。
呼吸道微生态与免疫防御的新视角
社区获得性肺炎(CAP)作为全球第五大死因,每年导致250万人死亡,其发病机制长期聚焦于病原体直接侵袭。然而近年研究发现,呼吸道核心菌群如普雷沃菌(Prevotella)、链球菌(Streptococcus)等可能通过微生态平衡参与疾病调控。但关键科学问题仍未解决:呼吸道共生菌如何动态变化?哪些菌种能调控宿主免疫?这种互作是否具有普适性?
中国医学科学院团队在《Signal Transduction and Targeted Therapy》发表的研究给出了突破性答案。通过对38例CAP患者纵向采集痰液、血液和粪便样本,结合22例流感患者的独立验证队列,首次绘制了从急性期到康复后4个月的呼吸道菌群全景图谱。研究采用深度宏基因组测序(>20G/样本)解析物种功能,通过加权基因共表达网络分析(WGCNA)整合宿主转录组,最终在小鼠模型中验证了口腔链球菌(Streptococcus oralis, SOR)的免疫保护机制。
关键技术方法
研究纳入38例CAP患者(中位年龄68岁)和33名健康对照,纵向收集急性期3个时间点(T1-T3)及康复期痰液样本,采用DNeasy PowerSoil Pro Kit提取DNA,Illumina HiSeq 4000平台进行宏基因组测序。通过Kraken2和StrainPhlAn4进行物种/菌株分析,HUMAnN3注释功能通路。宿主免疫分析采用PAXgene采血管收集全血RNA,NovaSeq 6000测序后通过WGCNA构建基因模块。动物实验以C57BL/6小鼠为模型,鼻内接种105 CFU SOR或乳酸杆菌LGG(Lactobacillus rhamnosus GG)后感染H1N1(PR8株),通过肺组织转录组和病理学评估保护效应。
主要研究结果
呼吸道菌群持续失调特征
宏基因组分析显示CAP患者α多样性显著降低(p=0.02),且恢复期仍未能完全复原。链球菌属(Streptococcus)在急性期占比达8.9-21.4%,随访期进一步升至19%,显著高于健康对照。共现网络分析揭示患者样本中菌群互作边数仅健康组的22%(96 vs 433边/样本),提示生态网络严重破坏。
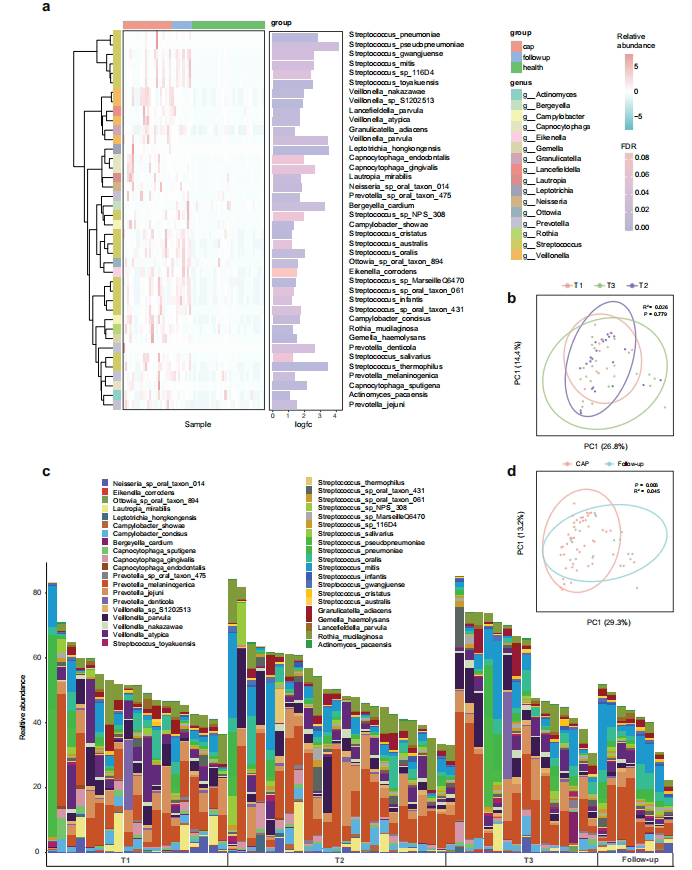
病原相关功能通路富集
KEGG分析发现CAP组显著富集肽聚糖生物合成(由链球菌贡献76.5%)和O-抗原核苷酸糖通路(链球菌/普雷沃菌共同主导)。这些通路涉及细菌细胞壁强化和免疫逃逸,其中rfbP基因(O-抗原合成关键酶)丰度增加3.2倍,暗示菌群通过强化细胞壁抵抗宿主免疫压力。
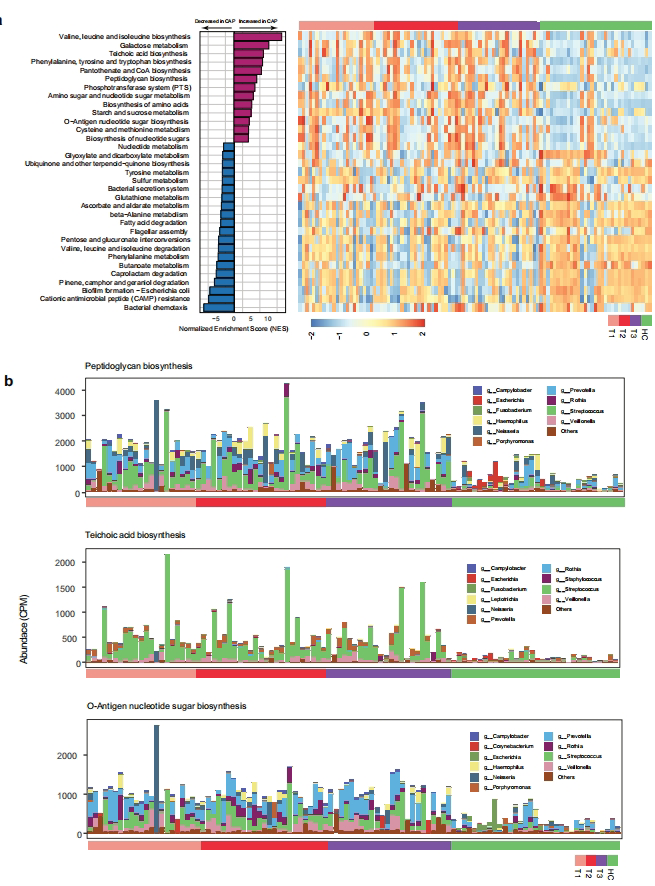
宿主-菌群互作枢纽发现
WGCNA鉴定出与先天免疫相关的salmon模块(含IL17F、LY6I等基因)与SOR显著相关(r=0.62, p<0.001)。在流感队列中,SOR同样关联到turquoise模块的病毒应答通路,证实其免疫调控的普适性。
SOR的免疫保护机制
小鼠实验中,SOR预处理使流感感染存活率从30%提升至70%,效果优于LGG(60%)。转录组显示SOR在感染早期(2天)强烈激活IL-17信号和补体通路,但到恢复期(6天)炎症因子迅速消退。这种"及时启动-适时消退"的模式使肺病毒载量降低2.4 log,同时减轻肺泡损伤(BALF蛋白减少38%)。
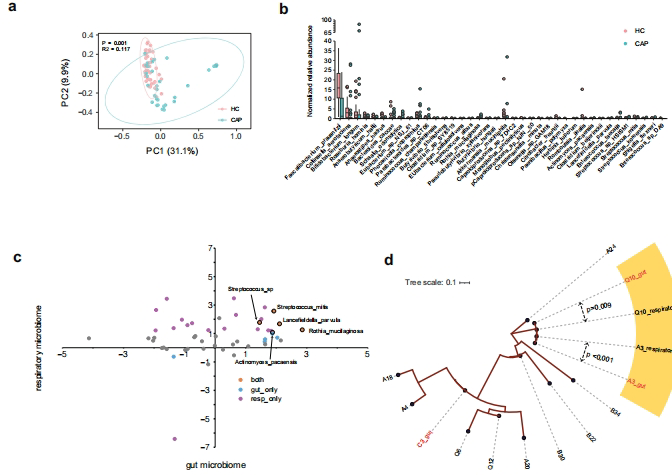
研究启示与展望
该研究突破传统"病原体-宿主"二元论,揭示呼吸道共生菌通过表观遗传调控(如肽聚糖诱导训练免疫)增强宿主防御的新机制。SOR展现的"免疫启动剂"特性为CAP防治提供新思路:或可开发基于呼吸道益生菌的鼻喷制剂,在流感季前进行黏膜免疫预激。未来需在更大队列验证SOR对不同病原体的广谱保护效果,并探索其与现有疫苗的协同作用。
研究也存在局限性:样本量较小(n=38),且健康对照来自历史数据。但通过独立流感队列验证和动物实验,显著增强了结论可靠性。该成果为理解呼吸道微生态-免疫轴提供了里程碑式的证据链,标志着肺炎防治策略从"杀菌"向"菌群调控"的重要转变。
 生物通微信公众号
生物通微信公众号
生物通 版权所有