编辑推荐:
本研究揭示了隐孢子虫(Cryptosporidium parvum)多药耐药蛋白CpMRP1通过外排次级胆汁酸脱氧胆酸(DCA)抵抗宿主肠道微生物抑制的分子机制。研究人员通过遗传图谱和功能实验证实,CpMRP1多态性决定虫株毒力差异,为理解寄生虫-微生物互作提供了新视角,对开发抗隐孢子虫策略具有重要意义。
隐孢子虫(Cryptosporidium parvum)是导致婴幼儿腹泻的重要病原体,尤其在发展中国家造成严重疾病负担。尽管已知不同虫株存在毒力差异,但决定其感染结局的遗传因素仍不清楚。这项发表在《Cell Host & Microbe》的研究首次揭示,隐孢子虫通过多药耐药蛋白CpMRP1抵抗宿主肠道微生物产生的毒性代谢物,从而维持其感染能力。
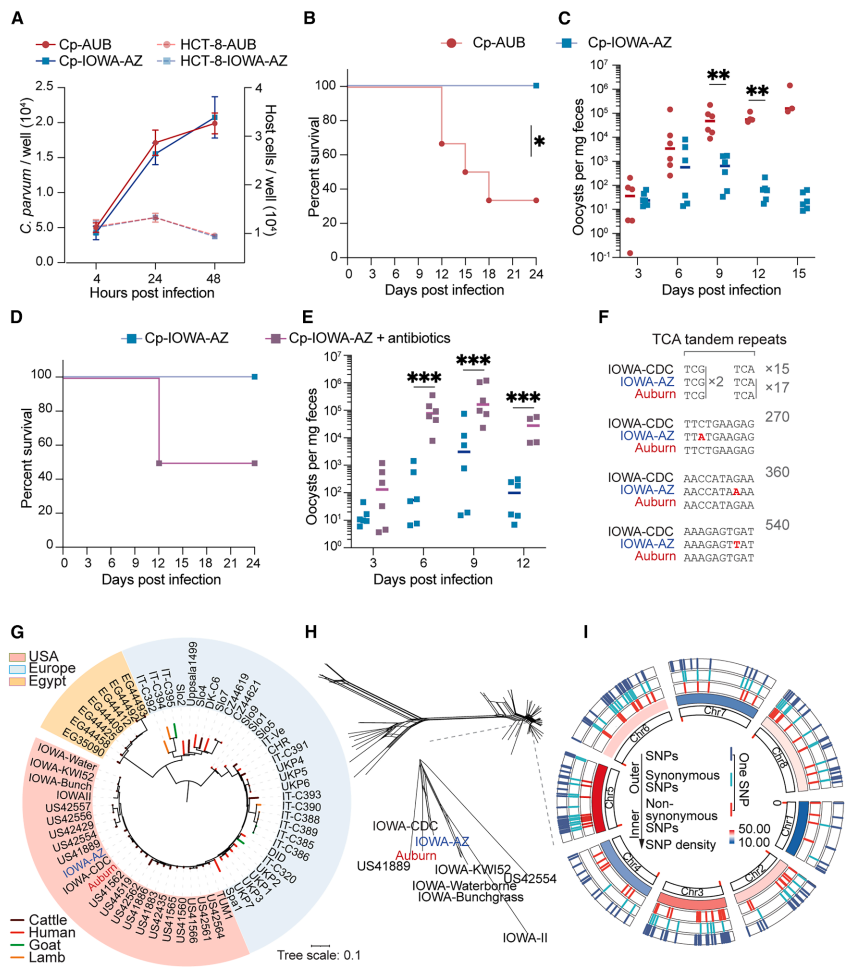
研究人员采用全基因组测序(WGS)、批量分离分析(BSA)和CRISPR-Cas9基因编辑等关键技术,比较了毒力差异的隐孢子虫IOWA-AZ和AUB虫株。实验使用免疫缺陷小鼠模型(包括IFN-γ受体敲除小鼠)和体外培养系统,结合抗生素处理揭示微生物组的影响。
遗传图谱定位毒力决定因子
通过比较遗传相似但毒力不同的虫株,发现IOWA-AZ在免疫缺陷小鼠中感染性显著降低,但该缺陷可通过抗生素处理恢复。遗传交叉和QTL定位将差异表型关联至染色体7的ABC转运体基因cgd7_4520(命名为CpMRP1)。
CpMRP1的结构与功能特征
该蛋白具有典型的多药耐药蛋白(MRP)结构域,AlphaFold预测显示其含两个核苷酸结合域(NBD)和跨膜区(TMR)。关键的是,AUB虫株的CpMRP1存在T310K和S299N突变,使其对DCA的结合亲和力比IOWA-AZ高10倍。
微生物代谢物抵抗机制
分子对接显示CpMRP1特异性结合次级胆汁酸DCA。敲除CpMRP1或替换为IOWA-AZ等位基因均使寄生虫对DCA敏感性增加,EC50显著降低。在新生小鼠模型中,DCA处理选择性地抑制了CpMRP1缺陷虫株的生长。
生物学意义与展望
该研究首次阐明隐孢子虫通过ABC转运体抵抗宿主微生物防御的分子机制,揭示了寄生虫基因型与宿主微生物组的复杂互作。CpMRP1多态性在不同虫株间的保守性提示其在宿主适应中的广泛作用,为开发针对寄生虫-微生物互作的干预策略提供了新靶点。研究建立的遗传分析平台也为解析其他复杂性状提供了范例。


 生物通微信公众号
生物通微信公众号
生物通 版权所有